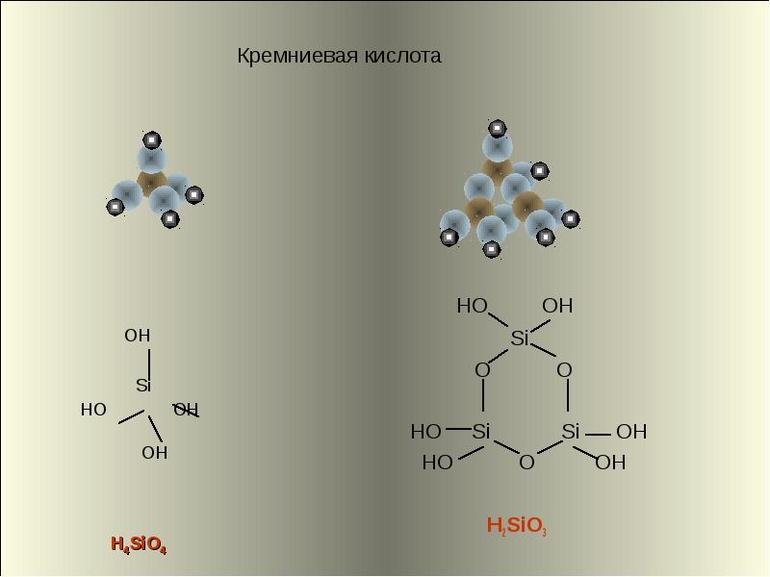
Кремниевая кислота
H2SiO3
— очень слабая, нерастворимая в воде кислота. Её получают в виде студенистого осадка при действии сильных кислот на растворы силикатов:
.
Кремниевая кислота настолько слабая, что её можно вытеснить из солей даже угольной кислотой:
.
Гелеобразный осадок кремниевой кислоты через некоторое время загустевает и заполняет весь объём сосуда.
Особенности свойств кремниевой кислоты объясняются её строением. Кремниевая кислота не имеет постоянного состава, поэтому вместо формулы
H2SiO3
иногда используют запись
SiO2⋅nH2O
. Кислота имеет полимерное строение:
Кремниевая кислота неустойчивая и при длительном хранении или повышенной температуре разлагается на воду и оксид кремния((IV)):
Oксид кремния((IV)) образуется в виде пористого твёрдого вещества — силикагеля.
Кремниевая кислота не растворяется в воде, не диссоциирует, не изменяет окраску индикаторов. Как все кислоты, она реагирует с основными и амфотерными оксидами и гидроксидами. В результате реакций образуются соли силикаты (Na2SiO3, CaSiO3).
Из силикатов растворимы только соли щелочных металлов, и их называют растворимым или жидким стеклом. Силикаты натрия и калия входят в состав силикатного клея.
Концентрированные растворы этих солей используются для пропитки деревянных изделий и тканей с целью придания им огнеупорных свойств. При высыхании силикаты образуют стеклоподобный слой, который не пропускает воду, поэтому применяются и в качестве водоотталкивающих покрытий.
В природе встречаются силикаты и алюмосиликаты. К ним относятся гранит, слюда, асбест, глина. Это доступное сырьё давно освоено человеком и широко используется в строительстве.
Глина легко формуется, при спекании становится твёрдой, поэтому она нашла применение для изготовления керамических изделий.
Рис. (2). Изделия из глины
Рис. (3). Фарфоровая посуда
Рис. (4). Кирпич керамический
При нагревании глины с известняком получают важнейший строительный материал — цемент.
Рис. (5). Цемент
Источники:
Рис. 2. Изделия из глины https://cdn.pixabay.com/photo/2018/03/20/06/19/pottery-3242323_960_720.jpg
Рис. 3. Фарфоровая посуда https://cdn.pixabay.com/photo/2015/02/09/18/04/plate-629970_960_720.jpg
Рис. 4. Кирпич керамический https://cdn.pixabay.com/photo/2021/06/17/20/44/bricks-6344582_960_720.jpg
Рис. 5. Цемент https://image.shutterstock.com/image-photo/cement-mortar-trowel-placed-on-600w-1305458290.jpg
From Wikipedia, the free encyclopedia
(Redirected from Sillic Acid)
In chemistry, a silicic acid () is any chemical compound containing the element silicon attached to oxide (=O) and hydroxyl (−OH) groups, with the general formula [H2xSiOx+2]n or, equivalently, [SiOx(OH)4−2x]n.[1][2] Orthosilicic acid is a representative example. Silicic acids are rarely observed in isolation, but are thought to exist in aqueous solutions, including seawater, and play a role in biomineralization.[3] They are typically colorless weak acids that are sparingly soluble in water. Like the silicate anions, which are their better known conjugate bases, silicic acids are proposed to be oligomeric or polymeric. No simple silicic acid has ever been identified, since these species being primarily of theoretical interest.
Depending on the number of silicon atoms present, there are mono- and polysilicic (di-, tri-, tetrasilicic, etc.) acids. Well defined silicic acids have not been obtained in a form that has been characterized by X-ray crystallography.
Examples[edit]
| Formula | Name | Computed Structure |
|---|---|---|
| H 4SiO 4 or Si(OH) 4 |
orthosilicic acid | 
|
| H 2SiO 3 or SiO(OH) 2 |
metasilicic acid | 
|
| H 6Si 2O 7 or O(Si(OH) 3) 2 |
pyrosilicic acid | 
|
| H 2Si 2O 5 or Si 2O 3(OH) 2 |
disilicic acid | 
|
Reactions[edit]
Silicic acids can be seen as hydrated forms of silica, namely 2 H2xSiOx+2 = SiO2·(H2O)x. Indeed, in concentrated solutions, silicic acids generally polymerize and condense, and ultimately degrade to silicon dioxide and water. The intermediate stages may be very thick liquids or gel-like solids.[4][5][6] Dehydrating the latter yields a hard translucent form of silica with atomic-scale pores, called silica gel, which is widely used as water absorbent and drying agent.
Silica dissolves very sparingly in water[citation needed] and is present in seawater at concentrations below 100 parts per million. In such dilute solutions, silica is assumed to exist as orthosilicic acid. Theoretical computations indicate that the dissolution of silica in water proceeds through the formation of a SiO2·2H2O complex and then orthosilicic acid.[7]
The silicon–oxygen double bond of metasilicic acid, implied by the formula H2SiO3, is hypothetical or highly unstable. Such double bonds can be hydrated to a pair of hydroxyl (−OH) groups:[4]
For example,
or
Alternatively, metasilicic acid is liable to form cyclic polymers [−SiO(OH)2−]n, which can be opened by hydration to chain polymers HO[−SiO(OH)2−]nH. Similarly, disilicic acid is liable to form complex polymers with a tetravalent unit, [=Si2O3(OH)2=]n. Conversely, oligomeric and polymeric acids may depolymerize by hydrolysis of the Si−O−Si bridges, or such bridges may be created by condensation:
Like organic silanols, silicic acids are weak acids. Orthosilicic acid has calculated dissociation potentials pKa1 = 9.84, pKa2 = 13.2 at 25 °C.
Silicic acids and silicates in solution react with molybdate anions, yielding yellow silicomolybdate complexes. This reaction has been used to titrate the content of silicon in water solutions and determine their nature. In a typical preparation, monomeric orthosilicic acid was found to react completely in 75 seconds, dimeric pyrosilicic acid in 10 minutes, and higher oligomers in considerably longer time. The reaction is not observed with colloidal silica.[8]
The degree of polymerization of silicic acids in water solution can be determined by its effect on the freezing point of the solution (cryoscopy).[8]
History[edit]
Silicic acid was invoked by Jöns Jacob Berzelius in the early 19th century to explain the dissolution of silicon dioxide (silica, quartz) in water, namely through the hydration reaction:
Based on the vapor pressure curves for silica gel, Reinout Willem Van Bemellen argued that no silica hydrates existed, only silica gel. On the other hand, Gustav Tschermak von Seysenegg believed that he had observed different silicic acids as decomposition products of natural silicate gels.[9]
The first crystalline silicic acid was prepared from the phyllosilicate natrosilite (Na2Si2O5) in 1924. More than 15 crystalline acids are known and comprise at least six modifications of H2Si2O5. Some acids can adsorb and intercalate organic molecules, and therefore are interesting alternatives to silica.[10]
Preparation[edit]
Crystalline silicic acids can be prepared by removing the sodium cations from solutions of sodium silicates with an ion-exchange resin, or by treating sodium silicates with concentrated sulfuric acid.[10]
See also[edit]
- Boric acid
References[edit]
- ^ Greenwood, N. N.; Earnshaw, A. (2012). Chemistry of the Elements. Elsevier Science. p. 346. ISBN 978-0-08-050109-3. Retrieved July 27, 2022.
- ^ Iler, R. K. (1979). The Chemistry of Silica. New York: Wiley. ISBN 0-471-02404-X.
- ^ Frank Wigglesworth Clarke (1914). «The Silicic Acids» (PDF). The Constitution of the Natural Silicates. pp. 10–19.
- ^ a b W. E. Gye and W. J. Purdy (1922): «The Poisonous Properties of Colloidal Silica. I: The Effects of the Parenteral Administration of Large Doses». British Journal of Experimental Pathology, volume 3, issue 2, pages 75–85. PMC 2047780.
- ^ Katsumi Goto (1956): «Effect of pH on Polymerization of Silicic Acid». Journal of Physical Chemistry, volume 60, issue 7, pages 1007–1008. doi:10.1021/j150541a046.
- ^ Hans Ramberg (1952): «Chemical Bonds and Distribution of Cations in Silicates». The Journal of Geology, volume 60, issue 4, pages 331–355. doi:10.1086/625982.
- ^ Bhaskar Mondal, Deepanwita Ghosh, and Abhijit K. Das (2009): «Thermochemistry for silicic acid formation reaction: Prediction of new reaction pathway». Chemical Physics Letters, volume 478, issues 4–6, pages 115–119. doi:10.1016/j.cplett.2009.07.063.
- ^ a b G. B. Alexander (1953): «The Reaction of Low Molecular Weight Silicic Acids with Molybdic Acid». Journal of the American Chemical Society, volume 75, issue 22, pages 5655–5657. doi:10.1021/ja01118a054.
- ^ Robert Schwarz; Ernst Menner (1924), «Zur Kenntnis der Kieselsäuren», Ber. Dtsch. Chem. Ges. (in German), 57 (8): 1477–1481, doi:10.1002/cber.19240570850.
- ^ a b «Silicates», Ullmann’s Encyclopedia of Industrial Chemistry (7th ed.), 2007, doi:10.1002/14356007.a23_661.
From Wikipedia, the free encyclopedia
(Redirected from Sillic Acid)
In chemistry, a silicic acid () is any chemical compound containing the element silicon attached to oxide (=O) and hydroxyl (−OH) groups, with the general formula [H2xSiOx+2]n or, equivalently, [SiOx(OH)4−2x]n.[1][2] Orthosilicic acid is a representative example. Silicic acids are rarely observed in isolation, but are thought to exist in aqueous solutions, including seawater, and play a role in biomineralization.[3] They are typically colorless weak acids that are sparingly soluble in water. Like the silicate anions, which are their better known conjugate bases, silicic acids are proposed to be oligomeric or polymeric. No simple silicic acid has ever been identified, since these species being primarily of theoretical interest.
Depending on the number of silicon atoms present, there are mono- and polysilicic (di-, tri-, tetrasilicic, etc.) acids. Well defined silicic acids have not been obtained in a form that has been characterized by X-ray crystallography.
Examples[edit]
| Formula | Name | Computed Structure |
|---|---|---|
| H 4SiO 4 or Si(OH) 4 |
orthosilicic acid | 
|
| H 2SiO 3 or SiO(OH) 2 |
metasilicic acid | 
|
| H 6Si 2O 7 or O(Si(OH) 3) 2 |
pyrosilicic acid | 
|
| H 2Si 2O 5 or Si 2O 3(OH) 2 |
disilicic acid | 
|
Reactions[edit]
Silicic acids can be seen as hydrated forms of silica, namely 2 H2xSiOx+2 = SiO2·(H2O)x. Indeed, in concentrated solutions, silicic acids generally polymerize and condense, and ultimately degrade to silicon dioxide and water. The intermediate stages may be very thick liquids or gel-like solids.[4][5][6] Dehydrating the latter yields a hard translucent form of silica with atomic-scale pores, called silica gel, which is widely used as water absorbent and drying agent.
Silica dissolves very sparingly in water[citation needed] and is present in seawater at concentrations below 100 parts per million. In such dilute solutions, silica is assumed to exist as orthosilicic acid. Theoretical computations indicate that the dissolution of silica in water proceeds through the formation of a SiO2·2H2O complex and then orthosilicic acid.[7]
The silicon–oxygen double bond of metasilicic acid, implied by the formula H2SiO3, is hypothetical or highly unstable. Such double bonds can be hydrated to a pair of hydroxyl (−OH) groups:[4]
For example,
or
Alternatively, metasilicic acid is liable to form cyclic polymers [−SiO(OH)2−]n, which can be opened by hydration to chain polymers HO[−SiO(OH)2−]nH. Similarly, disilicic acid is liable to form complex polymers with a tetravalent unit, [=Si2O3(OH)2=]n. Conversely, oligomeric and polymeric acids may depolymerize by hydrolysis of the Si−O−Si bridges, or such bridges may be created by condensation:
Like organic silanols, silicic acids are weak acids. Orthosilicic acid has calculated dissociation potentials pKa1 = 9.84, pKa2 = 13.2 at 25 °C.
Silicic acids and silicates in solution react with molybdate anions, yielding yellow silicomolybdate complexes. This reaction has been used to titrate the content of silicon in water solutions and determine their nature. In a typical preparation, monomeric orthosilicic acid was found to react completely in 75 seconds, dimeric pyrosilicic acid in 10 minutes, and higher oligomers in considerably longer time. The reaction is not observed with colloidal silica.[8]
The degree of polymerization of silicic acids in water solution can be determined by its effect on the freezing point of the solution (cryoscopy).[8]
History[edit]
Silicic acid was invoked by Jöns Jacob Berzelius in the early 19th century to explain the dissolution of silicon dioxide (silica, quartz) in water, namely through the hydration reaction:
Based on the vapor pressure curves for silica gel, Reinout Willem Van Bemellen argued that no silica hydrates existed, only silica gel. On the other hand, Gustav Tschermak von Seysenegg believed that he had observed different silicic acids as decomposition products of natural silicate gels.[9]
The first crystalline silicic acid was prepared from the phyllosilicate natrosilite (Na2Si2O5) in 1924. More than 15 crystalline acids are known and comprise at least six modifications of H2Si2O5. Some acids can adsorb and intercalate organic molecules, and therefore are interesting alternatives to silica.[10]
Preparation[edit]
Crystalline silicic acids can be prepared by removing the sodium cations from solutions of sodium silicates with an ion-exchange resin, or by treating sodium silicates with concentrated sulfuric acid.[10]
See also[edit]
- Boric acid
References[edit]
- ^ Greenwood, N. N.; Earnshaw, A. (2012). Chemistry of the Elements. Elsevier Science. p. 346. ISBN 978-0-08-050109-3. Retrieved July 27, 2022.
- ^ Iler, R. K. (1979). The Chemistry of Silica. New York: Wiley. ISBN 0-471-02404-X.
- ^ Frank Wigglesworth Clarke (1914). «The Silicic Acids» (PDF). The Constitution of the Natural Silicates. pp. 10–19.
- ^ a b W. E. Gye and W. J. Purdy (1922): «The Poisonous Properties of Colloidal Silica. I: The Effects of the Parenteral Administration of Large Doses». British Journal of Experimental Pathology, volume 3, issue 2, pages 75–85. PMC 2047780.
- ^ Katsumi Goto (1956): «Effect of pH on Polymerization of Silicic Acid». Journal of Physical Chemistry, volume 60, issue 7, pages 1007–1008. doi:10.1021/j150541a046.
- ^ Hans Ramberg (1952): «Chemical Bonds and Distribution of Cations in Silicates». The Journal of Geology, volume 60, issue 4, pages 331–355. doi:10.1086/625982.
- ^ Bhaskar Mondal, Deepanwita Ghosh, and Abhijit K. Das (2009): «Thermochemistry for silicic acid formation reaction: Prediction of new reaction pathway». Chemical Physics Letters, volume 478, issues 4–6, pages 115–119. doi:10.1016/j.cplett.2009.07.063.
- ^ a b G. B. Alexander (1953): «The Reaction of Low Molecular Weight Silicic Acids with Molybdic Acid». Journal of the American Chemical Society, volume 75, issue 22, pages 5655–5657. doi:10.1021/ja01118a054.
- ^ Robert Schwarz; Ernst Menner (1924), «Zur Kenntnis der Kieselsäuren», Ber. Dtsch. Chem. Ges. (in German), 57 (8): 1477–1481, doi:10.1002/cber.19240570850.
- ^ a b «Silicates», Ullmann’s Encyclopedia of Industrial Chemistry (7th ed.), 2007, doi:10.1002/14356007.a23_661.
Кремниевая кислота
Строение молекулы и физические свойства
Кремниевые кислоты — очень слабые, малорастворимые в воде соединения общей формулы nSiO2•mH2O. Образует коллоидный раствор в воде.
Метакремниевая H2SiO3 существует в растворе в виде полимера:
Способы получения
Кремниевая кислота образуется при действии сильных кислот на растворимые силикаты (силикаты щелочных металлов).
Например, при действии соляной кислоты на силикат натрия:
Na2SiO3 + 2HCl → H2SiO3 + 2 NaCl
Видеоопыт получения кремниевой кислоты из силиката натрия можно посмотреть здесь.
Даже слабая угольная кислота вытесняет кремниевую кислоту из солей:
Na2SiO3 + 2Н2O + 2CO2 → 2NaHCO3 + H2SiO3
Химические свойства
1. Кремниевая кислота — нерастворимая. Кислотные свойства выражены очень слабо, поэтому кислота реагирует только с сильными основаниями и их оксидами:
Например, кремниевая кислота реагирует с концентрированным гидроксидом калия:
H2SiO3 + 4KOH → K2SiO3 + 4H2O
2. При нагревании кремниевая кислота разлагается на оксид и воду:
H2SiO3 → SiO2 + H2O
Силикаты
Силикаты — это соли кремниевой кислоты. Большинство силикатов нерастворимо в воде, кроме силикатов натрия и калия, их называют «жидким стеклом».
Способы получения силикатов:
1. Растворение кремния, кремниевой кислоты или оксида в щелочи:
H2SiO3 + 2KOH → K2SiO3 + 2H2O
Si + 2NaOH + H2O → Na2SiO3 + H2
SiO2 + 2KOH → K2SiO3 + H2O
2. Сплавление с основными оксидами:
СаО + SiO2 → CaSiO3
3. Взаимодействие растворимых силикатов с солями:
K2SiO3 + CaCl2 → CaSiO3 + 2KCl
Оконное стекло (натриевое стекло) — силикат натрия и кальция: Na2O·CaO·6SiO2.
Стекло получают при сплавлении в специальных печах смеси соды Na2CO3, известняка CaCO3 и белого песка SiO2:
6SiO2 + Na2CO3 + CaCO3 → Na2O·CaO·6SiO2 + 2CO2
Для получения специального стекла вводят различные добавки, так стекло содержащее ионы Pb2+ – хрусталь; Cr3+ – имеет зеленую окраску, Fe3+ – коричневое бутылочное стекло, Co2+ – дает синий цвет, Mn2+ – красновато-лиловый.
| Плавиковая кислота | |
 |
|
 |
|
| Общие | |
|---|---|
| Систематическое наименование | фтороводород |
| Традиционные названия | плавиковая кислота |
| Химическая формула | HF |
| Физические свойства | |
| Состояние (ст. усл.) | бесцветная жидкость |
| Молярная масса | 20.0063 г/моль |
| Плотность | 1.15 г/см³ |
| Термические свойства | |
| Температура плавления | −83.6 °C |
| Температура кипения | 19.5 °C |
| Температура вспышки | негорючая °C |
| Химические свойства | |
| pKa | 3,17 |
| Растворимость в воде | смешивается |
| Оптические свойства | |
| Показатель преломления | 1.00001 |
| Классификация | |
| Рег. номер CAS | 7664-39-3 |
| Регистрационный номер EC | 231-634-8 |
| RTECS | MW7875000 |
| Безопасность | |
| Токсичность |
0 4 2 |
Пла́виковая кислота́ (фтороводоро́дная кислота́, фтористоводоро́дная кислота́, гидрофторидная кислота́) — водный раствор фтороводорода (HF). Промышленностью выпускается в виде 40 % (чаще), а также 50 % и 72 % растворов. Название «плавиковая кислота» происходит от плавикового шпата, из которого получают фтороводород.
Содержание
- 1 Свойства
- 1.1 Физические
- 1.2 Химические
- 2 Техническая плавиковая кислота
- 3 Применение
- 4 Токсические свойства
- 5 Примечания
Свойства
Физические
Бесцветная жидкость. Растворение фтористого водорода в воде сопровождается довольно значительным выделением тепла (59,1 кДж/моль). Для него характерно образование содержащей 38,3 % HF и кипящей при 112 °C азеотропной смеси (по другим данным 37,5 % и tкип 109 °C). Такая азеотропная смесь получается в конечном счёте при перегонке как концентрированной, так и разбавленной кислоты.
При низких температурах фтористый водород образует нестойкие соединения с водой состава Н2О·HF, Н2О·2HF и Н2О·4HF. Наиболее устойчиво из них первое (tпл −35 °C), которое следует рассматривать как фторид гидроксония — [Н3O]F. Второе является гидрофторидом гидроксония [Н3O][HF2].
Химические
Плавиковая кислота — кислота средней силы (константа диссоциации составляет 6,8·10−4, степень диссоциации 0,1 н. раствора 9 %). Она разъедает стекло и другие силикатные материалы, поэтому плавиковую кислоту хранят и транспортируют в полиэтиленовой таре.
Реакция идёт по уравнению:
с выделением газообразного фторида кремния (SiF4).
Реагирует со многими металлами с образованием фторидов (свинец не растворяется в плавиковой кислоте, так как на его поверхности образуется нерастворимый фторид PbF2; платина и золото также не растворяются), не действует на парафин, который используют при хранении этой кислоты.
Техническая плавиковая кислота
Техническая плавиковая кислота обычно содержит ряд примесей — Fe, Rb, As, кременфтористоводородную кислоту Н2SiF6, SO2) и др.
Для грубой очистки её перегоняют в аппаратах из платины или свинца, отбрасывая первые порции дистиллята.
Для получения более чистой кислоты техническую кислоту переводят в гидродифторид калия, затем разлагают его нагреванием, растворяя фтористый водород в дистиллированной воде.
Крепкая плавиковая кислота (более 60 % HF) может сохраняться и транспортироваться в стальных емкостях. Для хранения плавиковой кислоты и работы с ней в лабораторных условиях наиболее удобны сосуды из тефлона, полиэтилена и других пластмасс.
Применение
Крупный потребитель фтороводородной кислоты — алюминиевая промышленность.
- Раствор фтороводорода применяется для прозрачного травления силикатного стекла (например — нанесение надписей — для этого стекло покрывают парафином, прорезая отверстия для травления). Матовое травление получают в парах фтороводорода.
- Для травления кремния в полупроводниковой промышленности.
- В составе травильных, травильно-полировальных смесей, растворов для электрохимической обработки нержавеющей стали и специальных сплавов.
- Получение фторидов, кремнефторидов и борфторидов, фторорганических соединений, а также соответствующих кислот (кремнефтороводородная кислота и борфтороводородная кислота), синтетических смазочных масел и пластических масс.
- Для растворения силикатов при различного рода анализах.
Токсические свойства
Плавиковая кислота ядовита. Обладает слабым наркотическим действием. Возможны острые и хронические отравления с изменением крови и кроветворных органов, органов пищеварительной системы, отёк легких.
Обладает выраженным ингаляционным действием, раздражающим действием на кожу и слизистые оболочки глаз (вызывает болезненные ожоги и изъязвления); кожно-резорбтивным, эмбриотропным, мутагенным и кумулятивным действием. Ей присвоен второй класс опасности для окружающей среды, в то время, как чистый фтороводород принадлежит к первому классу опасности.[1]
При попадании на кожу в первый момент не вызывает сильной боли, легко и незаметно всасывается, но через короткое время вызывает отёк, боль, химический ожог и общетоксическое действие. Симптомы от воздействия слабо концентрированных растворов могут появиться через сутки и даже более после попадания их на кожу.
При попадании в кровь через кожу связывает кальций крови и может вызвать нарушение сердечной деятельности. Ожоги площадью более чем 160 см2 опасны возможными системными токсическими проявлениями.
Токсичность плавиковой кислоты и её растворимых солей предположительно объясняется способностью свободных ионов фтора связывать биологически важные ионы кальция и магния в нерастворимые соли (см. Отравление фторидами (англ.)). Поэтому для лечения последствий воздействия плавиковой кислоты часто используют глюконат кальция, как источник ионов Ca2+. Пострадавшие учаски при ожогах плавиковой кислотой промываются водой и обрабатываются 2,5 % гелем глюконата кальция.[2][3]. Тем не менее, поскольку кислота проникает сквозь кожу, простого промывания недостаточно и необходимо обращение к врачу для проведения лечения.[4] Высокую эффективность показали внутриартериальные инфузии хлорида кальция.[5]
Предельно допустимая концентрация (ПДК) плавиковой кислоты:
| Вид | ПДК максимально разовая (ПДКм.р.) | ПДК среднесуточная (ПДКс.с.) |
|---|---|---|
| ПДК в воздухе рабочей зоны, мг/м³ (в пересчёте на фтор) | 0,5 | 0,1 |
| ПДК в атмосферном воздухе, мг/м³ (в пересчёте на фтор) | 0,02 | 0,005 |
Примечания
- ↑ ГОСТ 12.1.007-76 — Система стандартов безопасности труда. Вредные вещества
- ↑ el Saadi MS, Hall AH, Hall PK, Riggs BS, Augenstein WL, Rumack BH (1989). «Hydrofluoric acid dermal exposure». Vet Hum Toxicol 31 (3): 243–7. PMID 2741315.
- ↑ Roblin I, Urban M, Flicoteau D, Martin C, Pradeau D (2006). «Topical treatment of experimental hydrofluoric acid skin burns by 2.5% calcium gluconate». J Burn Care Res 27 (6): 889–94. DOI:10.1097/01.BCR.0000245767.54278.09. PMID 17091088.
- ↑ Recommended Medical Treatment for Hydrofluoric Acid Exposure (PDF). Honeywell Specialty Materials. Архивировано из первоисточника 2 февраля 2012. Проверено 6 мая 2009.
- ↑ Intra-arterial calcium infusion for hydrofluoric acid burns. NCBI. Проверено 3 января 2010.
|
Соединения фтора |
|---|
|
Гексафторалюминат натрия (Na3AlF6) • Гексафтороантимонат водорода (HSbF6) • Гексафторид платины (PtF6) • Гексафторид селена (SeF6) • Гексафторид теллура (TeF6) • Гексафторогерманат калия (K2[GeF6]) • Гексафторогерманат рубидия (Rb2[GeF6]) • Гексафторогерманат цезия (Cs2[GeF6]) • Гексафторосиликат(IV) калия (K2[SiF6]) • Гексафторосиликат натрия (Na2SiF6) • Гексафторплатинат ксенона (XePtF6) • Гексафторсиликат аммония ((NH4)2SiF6) • Гептафторид рения (ReF7) • Гептафторониобат(V) калия (K2[NbF7]) • Гидрофторид аммония ([NH4][HF2]) • Гидрофторид калия (HF2K) • Декафторид дисеры (S2F10) • Диоксидифторид (F2O2) • Диоксидифторид молибдена(VI) (MoF2O2) • Дифтордиазин (N2F2) • Дифторид радона (F2Rn) • Кремнефтористоводородная кислота (H2SiF6) • Монофторид алюминия (AlF) • Монофторид углерода (CF) • Оксид-фторид урана (UO2F2) • Окситетрафторид вольфрама(VI) (WOF4) • Окситетрафторид молибдена(VI) (MoOF4) • Оксифторид иттрия (YOF) • Оксифторид лантана(III) (LaOF) • Оксотетрафторид ксенона (XeOF4) • Оксотрифторид ванадия(V) (F3OV) • Пентафторид висмута (BiF5) • Пентафторид мышьяка (AsF5) • Пентафторид сурьмы (SbF5) • Пентафторид урана (UF5) • Пентафторид фосфора (PF5) • Субфторид серебра (Ag2F) • Тетрафторалюминат калия (KAlF4) • Тетрафтороборат лития (LiBF4) • Тетрафтороборат меди(II) (Cu(BF4)2) • Тетрафтороборат натрия (NaBF4) • Тетрафтороборат нитрозила (BF4NO) • Тетрафтороборат нитрония (BNO2F4) • Тетрафтороборат серебра (AgBF4) • Тетрафторборная кислота (HBF4) • Тетрафторид дибора (B2F4) • Тетрафторид кремния (SiF4) • Тетрафторид селена (SeF4) • Тетрафторид теллура (TeF4) • Тетрафторгидразин (N2F4) • Трифторид алюминия (AlF3) • Трифторид бора (BF3) • Трифторид мышьяка (AsF3) • Трифторид висмута (BiF3) • Трифторид сурьмы (SbF3) • Трифторид тиазила (NSF3) • Трифторид фосфора (PF3) • Фторфосфат натрия (Na2PFO3) • Фторамин (NH2F) • Фторид азота(III) (NF3) • Фторид аммония (NH4F) • Фторид бария (BaF2) • Фторид бериллия (BeF2) • Фторид брома(I) (BrF) • Фторид брома(III) (BrF3) • Фторид брома(V) (BrF5) • Фторид ванадия(III) (VF3) • Фторид ванадия(IV) (VF4) • Фторид ванадия(V) (VF5) • Фторид вольфрама(VI) (WF6) • Фторид галлия(III) (GaF3) • Фторид гафния(IV) (HfF4) • Фторид дейтерия (DF) • Фторид диртути(2+) (Hg2F2) • Фторид железа(II) (FeF2) • Фторид железа(III) (FeF3) • Фторид золота(III) (AuF3) • Фторид золота(V) (AuF5) • Фторид индия(III) (InF3) • Фторид иода(I) (IF) • Фторид иода(III) (IF3) • Фторид иода(V) (IF5) • Фторид иода(VII) (IF7) • Фторид иридия(IV) (IrF4) • Фторид иридия(V) (IrF5) • Фторид иридия(VI) (IrF6) • Фторид иттербия(III) (YbF3) • Фторид иттрия (YF3) • Фторид иттрия-лития (LiYF4) • Фторид кадмия (CdF2) • Фторид калия (KF) • Фторид кальция (CaF2) • Фторид кислорода(II) (OF2) • Фторид кобальта(II) (CoF2) • Фторид кобальта(III) (CoF3) • Фторид криптона(II) (KrF2) • Фторид ксенона(II) (XeF2) • Фторид ксенона(IV) (XeF4) • Фторид ксенона(VI) (XeF6) • Фторид лития (LiF) • Фторид магния (MgF2) • Фторид марганца(II) (MnF2) • Фторид марганца(III) (MnF3) • Фторид меди(I) (CuF) • Фторид меди(II) (CuF2) • Фторид молибдена(VI) (MoF6) • Фторид натрия (NaF) • Фторид никеля(II) (NiF2) • Фторид ниобия(V) (NbF5) • Фторид нитрозила) (NOF) • Фторид оксида азота(IV) (NO2F) • Фторид оксида серы(IV) (SO2F2) • Фторид олова(II) (SnF2) • Фторид олова(IV) (SnF4) • Фторид плутония(III) (PuF3) • Фторид плутония(IV) (PuF4) • Фторид плутония(VI) (PuF6) • Фторид радия (RaF2) • Фторид рения(IV) (ReF4) • Фторид рения(VI) (ReF6) • Фторид рения(VII) (ReF7) • Фторид ртути(II) (HgF2) • Фторид рубидия (RbF) • Фторид самария(III) (SmF3) • Фторид свинца(II) (PbF2) • Фторид серебра(I) (AgF) • Фторид серебра(II) (AgF2) • Фторид серы(IV) (SF4) • Фторид серы(VI) (SF6) • Фторид скандия(III) (ScF3) • Фторид стронция (SrF2) • Фторид таллия(I) (TlF) • Фторид тантала(V) (TaF5) • Фторид теллура(IV) (TeF4) • Фторид технеция(VI) (TcF6) • Фторид тиазила (NSF) • Фторид тианила (SOF2) • Фторид титана(III) (TiF3) • Фторид титана(IV) (TiF4) • Фторид тория(IV) (ThF4) • Фторид урана(III) (UF3) • Фторид урана(IV) (UF4) • Фторид урана(V) (UF5) • Фторид урана(VI) (UF6) • Фторид хлора(I) (ClF) • Фторид хлора(III) (ClF3) • Фторид хлора(V) (ClF5) • Фторид хрома(III) (CrF3) • Фторид хрома(IV) (CrF4) • Фторид хрома(V) (CrF5) • Фторид цезия (CsF) • Фторид цинка (ZnF2) • Фторид циркония(IV) (ZrF4) • Фторид-хлорид оксида серы(IV) (ClFO2S) • Фторноватистая кислота (HOF) • Фтороводород (HF) • Фторосульфоновая кислота (FSO3H) • Фторид хлорила (ClO2F) • Фторид перхлорила (ClO3F) • Фторид оксиперхлорила (ClO3OF) |
Общая информация
Основная формула кремниевой кислоты — H2SiO3 (так как кислота не имеет постоянного состава, её обозначение иногда принимает вид nSiO2 • mH2O, что соответствует поликремниевым видам). Номенклатура кислоты включает в себя и её подвиды. Условное обозначение их химического состава выглядит следующим образом:
- Ортокремниевая — H4SiO4. Наряду с метакремниевой кислотой, чья формула считается основной, ортокремниевая является наиболее распространённым химическим соединением кислот этого вида.
- Дикремниевая — H2Si2O5, H6Si2O7 и H10Si2O9 (показатель растворимости в воде при t = 20 градусов по цельсию составляет 2,9310 в минус 4 степени моль/л).
- Пирокремниевая — H6Si2O7.
Соли кремниевых кислот обозначаются как силикаты. Поликремниевые кислоты состоят из структурных звеньев, соединяющихся в сложные линейные и разветвлённые цепи. Несмотря на различие в формулах и отдельных характеристиках кремниевой кислоты, все виды этих химических соединений имеют тетраэдрическое строение.
Особенности силикатов
В природе широко распространены (в частности, к ним относятся полевые шпаты, асбест, тальк, слюда и различные виды глины). Соли кремниевой кислоты в большинстве своём плохо растворимы в воде (исключения составляют силикаты калия и натрия). Получение солей происходит при сплавлении едких щёлочей или карбонатами натрия и калия с диоксидом кремния. В остатке выходит диоксид углерода с высокой массовой долей вещества или вода. Примерами таких уравнений могут послужить следующие реакции:
- SiO2 + K2CO3 = K2SiO3 + CO2 (образование углекислого газа).
- SiO2 + 2NaOH = Na2SiO3 + H2O.
- SiO2 + Na2CO3 = Na2SiO3 + CO2.
К свойствам солей относится высокая температура плавления: в среднем — от 1000 до 1300 градусов по Цельсию (такая разновидность силикатов, как каолинит, плавится при t = 1800 и выше). Твёрдость этих веществ по шкале Мооса составляет 6−8 баллов, что является высоким показателем.
Несмотря на то что силикаты не реагируют на отдельные соединения и в целом относятся к классу химически пассивных веществ, они способны взаимодействовать со слабыми кислотами и растворимыми солями. Формула гидролиза представляет собой уравнение: Na2SiO3 + H2O = NaHSiO3 + NaOH. Расплавленные силикаты имеют высокие электролитические свойства.
Ещё одной особенностью солей кремниевых соединений является их возможность замещать атомы кремния на атомы алюминия, образуя при этом алюмосиликаты. Они также нерастворимы в воде и обладают абсорбционными, ионообменными, диэлектрическими и термостойкими свойствами.
Физические и химические свойства
Неорганическая кислота образуется при действии сильных кислот на растворимые силикаты. Вещество представляет собой белый аморфный и стекловидный полимер, имеющий цепочечную структуру. Не вступает в реакцию с другими кислотами и не гидратом аммиака. Так как все поликремниевые соединения относятся к малорастворимым веществам, они образуют коллоидные растворы при реакции с водой. Молярная масса вещества равна 78 а. е. м. (H2SiO3 — 2 атома водорода = 1 • 2, 1 атом кремния = 28 и 3 атома кислорода = 16 • 3).
Кислотные свойства выражены очень слабо (у молекулы вещества степень окисления кремния равна +4), вещество не имеет кислого вкуса или запаха, а также не изменяет окраску индикатора. Согласно таблице сильных и слабых кислот, кремниевая занимает последнюю строчку). Константа диссоциации для метакремниевых соединений составляет K1 = 1,3•10 -10, K2 = 1,6•10 -12, а для ортокремниевой K1 = 2•10 -10, K2 = K3 = K4 = 2•10 -12 .
Вследствие своей неустойчивости химическое вещество при нагревании либо длительном хранении разлагается на оксид кремния и воду (реакция термического разложения H2SiO3 = H2O + SiO2). Каждый атом кремния в кристаллах (SiO2) окружён 4 атомами кислорода, которые, будучи связаны друг с другом, образуют кристаллическую трёхмерную решётку, что обусловливает твёрдость вещества. Некоторые другие химические свойства кремниевых кислот можно проиллюстрировать следующими уравнениями:
- H2SiO3 + 4KOH = K2SiO3 + 4H2O (растворение студенистого кислотного остатка и образование средней соли метасиликата калия и воды).
- 2H4SiO4 = (HO)3SiOSi (OH)3 + H2O (эта реакция называется поликонденсацией).
- Пример взаимодействия с плавиковой кислотой и образованием газообразного фторида кремния: H2SiO3 + 6HF = H2SiF6 + 3H2O = SiF4 (образование газа) + 2HF (фтороводород) + 3H2O.
- CaCl2 + Na2SiO3 = 2NaCl + CaSiO3 (химическая реакция двух солей с выпадением осадка).
В присутствии щёлочных катализаторов — к примеру, NaOH — ортокремниевая кислота может образовывать эфиры-ортосиликаты. В большинстве своём они имеют вид R1R2R3R4SiO3, где R1−4 являются органическими радикалами. Примером такого эфира является распространённый тетраэтилортосиликат с формулой Si (C2H5O)4.
Способы получения
Основной способ получения кремниевой кислоты — косвенным путём, воздействуя сильной кислотой на силикат калия или натрия (Na2SiO3 + 2HCl = H2SiO3 + 2NaCl). При этом невозможно получить кислоту в чистом виде — в водном растворе образуется золь, который через малый промежуток времени превращается в гель.
Кремниевые соединения также можно получить посредством гидролиза хлорсиланов (SiH2Cl2 + 3H2O = H2SiO3 +2HCl + 2H2); конечным продуктом гидролитического расщепления является H2SiO3. Наконец, для промышленных масштабов, а также для лабораторных экспериментов и отдельных опытов по химии могут использоваться методы электродиализа и ионного обмена. Большое внимание уделяется и получению силикагеля — другое название вещества, образовывающегося от перенасыщенных растворов кремниевых кислот. Технология производства включает в себя несколько стадий:
- Возникновение золя и его застудневание в однородную массу (гидрогель).
- Созревание (последующее гелеобразование и разжижение вещества).
- Очищение и промывка геля от солей.
- Высушивание и превращение вещества в ксерогель.
Опытным путём доказано, что наиболее чистый силикагель получается при гидролизе соединений кремния (SiCl4), а также ортокремниевых соединений. Химическая формула получения геля выглядит так: Na2SiO3 + H2SO4 = nSiO2 • mH2O + Na2SO4, где nSiO2 • mH2O — гидратированный аморфный кремнезём.
Применение в различных отраслях
Благодаря пористой структуре силикагеля его часто применяют в качестве абсорбента для поглощения вредных газов и смесей. Для общественности известны медицинские высокопористые гели, эффективные при различного рода отравлениях и недомоганиях. Помимо этого, вещество используется и для создания технических фильтрационных систем.
Кремниевые соединения являются важным строительным элементом для кожи, волос и ногтей, поэтому эти вещества широко используются для производства косметики и лекарственных препаратов. Препараты на основе кремния обеспечивают гибкость соединительных тканей внутренних органов (в частности, кишечника и желудка) и улучшают усвоение кальция, что способствует восстановлению костной ткани.
В нефтяной промышленности гели на основе кремнийсодержащих веществ используются для очистки углеводородов от смол, а в ядерной отрасли при помощи силикагеля производится не только очистка сточных вод, но и разделение изотопов радиоактивных веществ.
Любопытно, что вещества на основе кремниевых соединений находят массу применений в повседневной жизни. К примеру, процесс сушки обуви займёт куда меньше времени, если в промокшие ботинки положить пакетик с соответствующим абсорбентом. Силикагель позволит избавиться от неприятных запахов в помещении или в сумке с вещами. Столовое серебро можно спасти от почернения, положив в шкаф с ценными приборам гелевые шарики на основе силикагеля.
Если необходимо продлить срок службы бритвенных лезвий, то для спасения от ржавчины нужно положить к ним несколько гранул с силикагелем. Это же относится и к хранению старых фотографий, а также других вещей, которые со временем могут потускнеть или изменить свой внешний вид под воздействием окружающей среды. Автолюбителям могут уменьшить запотевание ветрового стекла, всего лишь положив на приборную панель цветы или пакетик с силикагелем.

Iliya123
+32
Решено
10 лет назад
Химия
5 — 9 классы
Силикатная кислота H2SiO3 количеством 0,2 моль содержит:?
Смотреть ответ
1
Ответ
3
(2 оценки)
2
rickmanova
10 лет назад
Светило науки — 649 ответов — 14078 раз оказано помощи
H2O+SiO2=H2SiO3
M(H2SiO3)=2+28+16*3=78 г/моль
m(H2SiO3)=M*U=15,6 г
из уравнения U(H2O)=U(SiO2)=U(H2SiO3)=0,2 моль
M(H2O)=18 г/моль
M(SiO2)=16*2+48=80 г/моль
m(H2O)=M*U=3,6 г
m(SiO2)=16 г
(2 оценки)
https://vashotvet.com/task/218791