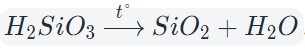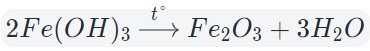Знакомство с оксидами обычно начинается на уроках химии в 8 классе. Из этой статьи вы узнаете, что такое оксиды в химии, их классификацию и свойства, а также способы получения.
Определение оксидов
Оксиды — это сложные вещества, состоящие из двух химических элементов (т. е. бинарные соединения), один из которых — кислород в степени окисления −2.
Общая формула оксидов: ЭxOy, где Э – химический элемент, а x и y — индексы, определяемые степенью окисления химических элементов.
Получай лайфхаки, статьи, видео и чек-листы по обучению на почту
Полезные подарки для родителей
В колесе фортуны — гарантированные призы, которые помогут наладить учебный процесс и выстроить отношения с ребёнком!
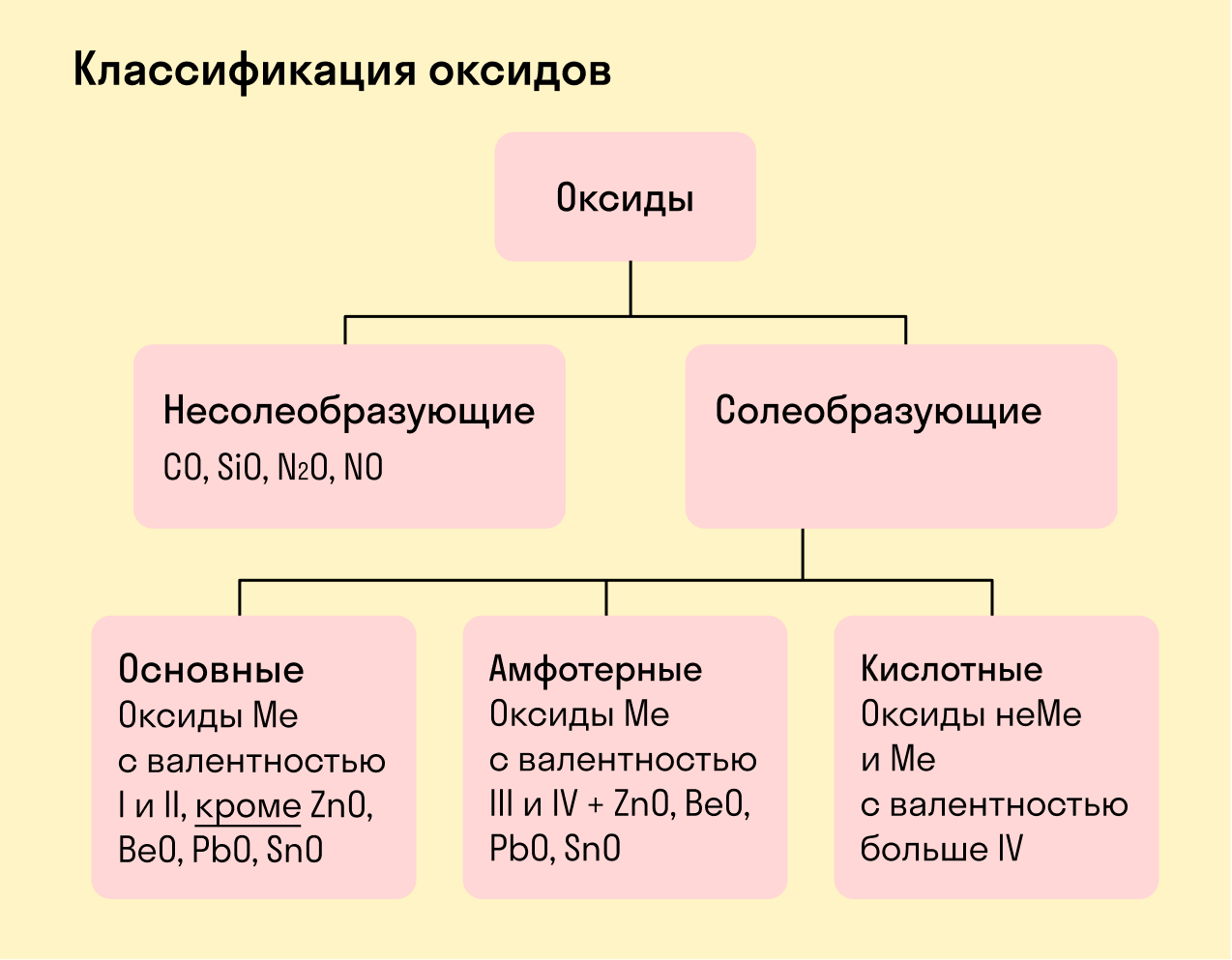
Виды оксидов
Все оксиды делятся на солеобразующие и несолеобразующие.
Несолеобразующие оксиды — это оксиды, которые не взаимодействуют с кислотами и щелочами, то есть не способны образовать соли.
К несолеобразующим оксидам относят: CO, SiO, N2O, NO.
Солеобразующие оксиды — это оксиды, которые взаимодействуют с кислотами и щелочами с образованием солей.
Солеобразующие оксиды делятся на три группы:
-
Основные оксиды — это оксиды, образованные металлами со степенью окисления +1 или +2.
Примеры основных оксидов: Na+12O, Ca+2O, Ba+2O.
-
Амфотерные оксиды — оксиды, образованные металлами со степенью окисления +3 или +4.
К амфотерным оксидам относят также: ZnO, BeO, PbO, SnO.
Несмотря на то, что эти металлы проявляют степень окисления +2 в данных соединениях, их оксиды проявляют амфотерные свойства.
Примеры амфотерных оксидов: Al+32O3, Fe2+3O3.
-
Кислотные оксиды — оксиды, образованные металлами с валентностью V и более или неметаллами с любой валентностью (за исключением несолеобразующих оксидов, то есть CO, SiO, N2O, NO).
Примеры кислотных оксидов: S+6O3, N2+5O5, Mn2+7O7.
Если один и тот же химический элемент образовывает несколько оксидов, то с увеличением степени окисления основные свойства оксидов ослабевают и усиливаются кислотные.
Например:
-
CrO (оксид хрома (II)) — проявляет основные свойства;
-
Cr2O3 (оксид хрома (III)) — проявляет амфотерные свойства;
-
CrO3 (оксид хрома (VI)) — проявляет кислотные свойства.
Закрепим знания о типах оксидов, изучив схему:
Номенклатура оксидов
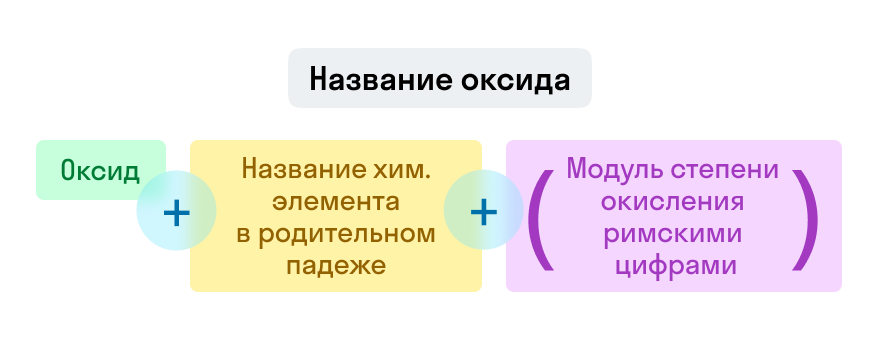
Названия оксидов строятся по систематической номенклатуре следующим образом:
-
Пишем слово «оксид».
-
Указываем название второго химического элемента в родительном падеже.
-
Если этот элемент имеет переменную валентность, то указываем валентность элемента в этом соединении в скобках римской цифрой.
Примеры названий оксидов:
-
Fe2O3 — оксид железа (III). Читается: феррум два о три.
-
Na2O — оксид натрия. Читается: натрия два о.
-
SO3 — оксид серы (VI). Читается: эс о три.
До появления систематической номенклатуры вещества называли по присущим им специфическим свойства (цвету, запаху и т. д.). Такой способ названия веществ — тривиальная номенклатура. Некоторые названия используются и сейчас.
Названия некоторых оксидов: таблица
|
Химическая формула оксида |
Бытовое (тривиальное название) |
Возможное научное название |
|---|---|---|
| H2O | Вода | Оксид водорода |
| CO2 | Углекислый газ | Оксид углерода (IV), диоксид углерода |
| CO | Угарный газ | Оксид углерода (II), монооксид углерода |
| SO3 | Серный газ | Оксид серы (VI), триоксид серы |
| SO2 | Сернистый газ | Оксиды серы (IV), диоксид серы |
| SiO2 | Кварц, горный хрусталь, песок кварцевый, речной и морской | Оксид кремния |
| Al2O3 | Глинозем | Оксид алюминия |
| Fe2O3 | Гематит (крокус) | Оксид железа (III) |
| CaO | Негашеная известь | Оксид кальция |
Химические свойства основных оксидов
1. Взаимодействие с водой
С водой способны реагировать оксиды тех металлов, которым соответствуют растворимые гидроксиды. То есть с водой реагируют только оксиды щелочных и щелочноземельных металлов.
|
Основный оксид + вода = основание Например: Na2O + H2O = 2NaOH |
|---|
Оксид магния взаимодействует с водой только при нагревании.
2. Взаимодействие с кислотными оксидами и кислотами
Основные оксиды, соответствующие щелочам, взаимодействуют со всеми кислотными оксидами и кислотами. Оксиды неактивных металлов взаимодействуют только с кислотными оксидами, соответствующими сильным кислотам, или с сильными кислотами.
|
Основный оксид + кислотный оксид = соль Например: BaO + SO3 = BaSO4 Основный оксид + кислота = соль + вода Например: Mg(OH)2 + 2HNO3 = Mg(NO3)2 + 2H2O |
|---|
3. Взаимодействие с амфотерными оксидами
В эту реакцию могут вступать только основные оксиды щелочных или щелочноземельных металлов. При сплавлении двух оксидов образуется соль.
|
Основный оксид + амфотерный оксид = соль Например: Na2O + Al2O3 = NaAlO2 |
|---|
Как составлять такие соли: металл в этой соли берем из основного оксида, а кислотный остаток из амфотерного оксида (они проявляют более кислотные свойства).
Химические свойства кислотных оксидов
1. Взаимодействие с водой
Кислотные оксиды взаимодействуют с водой с образованием соответствующих кислот. За исключением SiO2, которому соответствует нерастворимая кремниевая кислота.
|
Кислотный оксид + вода = кислота Например: SO3 + H2O = H2SO4 |
|---|
2. Взаимодействие с основными оксидами и щелочами
Кислотные оксиды сильных кислот способны взаимодействовать с любыми основными оксидами или основаниями.
|
Кислотный оксид + основный оксид = соль Например: SO3 + CuO = CuSO4 Кислотный оксид + основание = соль + вода Например: N2O5 + 2NaOH = 2NaNO3 + H2O |
|---|
Кислотные оксиды, соответствующие слабым кислотам (такие как CO2, SO2), способны взаимодействовать с основными оксидами, соответствующим щелочам, а также с щелочами.
3. Взаимодействие с амфотерными оксидами и гидроксидами
С амфотерными оксидами в реакцию вступают кислотные оксиды — как правило, сильных кислот.
|
Кислотный оксид + амфотерный оксид = соль Например: SO3 + Al2O3 = Al2(SO4)3 Кислотный оксид + амфотерный оксид = соль + вода Например: SO3 + Al(OH)3 = Al2(SO4)3 + H2O |
|---|
Химические свойства амфотерных оксидов
1. Взаимодействие с водой
Амфотерные оксиды не взаимодействуют с водой — даже при нагревании!
|
Амфотерный оксид + вода ≠ |
|---|
2. Взаимодействие с кислотными оксидами и кислотой
Амфотерные оксиды взаимодействуют только с сильными и средними кислотами и их оксидами.
|
Амфотерный оксид + кислотный оксид = соль Например: Al2O3 + N2O5 = 2Al(NO3)3 Амфотерный оксид + кислота = соль + вода Например: Al2O3 + 6HCl = 2AlCl3 + 3H2O |
|---|
3. Взаимодействие с основными оксидами
Амфотерные оксиды взаимодействуют только с теми оксидами, которые соответствуют щелочам. Реакция протекает только в расплаве, так как в растворе такие оксиды взаимодействуют преимущественно с водой с образованием щелочей.
|
Амфотерный оксид + основный оксид (расплав) = соль Например: Al2O3 + Na2O = 2NaAlO2 |
|---|
4. Взаимодействие со щелочами
Продукты взаимодействия амфотерных оксидов со щелочами зависят от условий проведения реакции. В растворе образуются комплексные соли, а при сплавлении – средние соли.
|
Амфотерный оксид + щелочь (раствор) + вода = комплексная соль Например: Al2O3 + 2NaOH + 3H2O = 2Na[Al(OH)4] Амфотерный оксид + щелочь (расплав) = средняя соль + вода Например: ZnO + 2KOH = K2ZnO2 + H2O |
|---|
Получение оксидов
1. Окисление металлов
Почти все металлы окисляются кислородом до устойчивых степеней окисления.
Например: 4Al + 3O2 = 2Al2O3
Исключение
Не взаимодействуют с кислородом: платина, золото и палладий.
Металлы с переменной степенью окисления, как правило, образуют соединения в степени окисления +3:
4Cr + 3O2 = 2Cr2O3
При взаимодействии щелочных металлов (элемента IA группы) образуются пероксиды Me2O2 или надпероксиды MeO2, где Ме — щелочной металл.
2. Окисление простых веществ — неметаллов
При окислении неметаллов в избытке кислорода, как правило, образуются высшие оксиды (это оксиды, в которых неметалл проявляют высшую степень окисления):
4P + 5O2 (избыток) = 2P2O5
При недостаточном количестве кислорода образуются оксиды неметаллов в промежуточной степени окисления:
4P + 3O2 (недостаток) = 2P2O3
Существуют и исключения. Например, сера окисляется лишь до оксида серы (IV) даже в избытке кислорода:
S + O2 = SO2
Или азот, который взаимодействует с кислородом только при температуре 2 000̊С или под действием электрического разряда с образованием оксида азота (II):
N2 + O2 = 2NO
Запомнить
Галогены (элементы VIIA группы) вовсе не взаимодействуют с кислородом, так же как и инертные газы (элементы VIIIA группы).
3. Разложение гидроксидов
Некоторые кислоты и гидроксиды неустойчивы и самопроизвольно разлагаются по схеме:
Гидроксид (кислота) = оксид + вода
Например:
H2SO3 = SO2↑ + H2O
H2CO3 = CO2↑ + H2O
Ag(OH) = Ag2O + H2O
NH4OH = NH3↑ + H2O
Оксиды тяжелых металлов (нерастворимые гидроксиды) и кремниевая кислота разлагаются при нагревании по той же самой схеме.
Например:
4. Окисление сложных веществ
Сложные бинарные (состоящие из двух химических элементов) соединения окисляются с образованием двух оксидов этих элементов в устойчивых степенях окисления.
Например:
2H2S + 3O2 = 2SO2 + 2H2O
4NH3 + 5O2 = 4NO + 6H2O
Также оксиды получают разложением солей, например, карбонатов, нитратов сульфатов и т. д.
Например, Li2CO3 = Li2O + CO2↑
Мы узнали, какие вещества в химии называют оксидами, какие бывают оксиды, а также разобрали свойства каждого вида. Осталось подкрепить теорию практикой — а сделать это можно на курсах по химии в онлайн-школе Skysmart!
Таблица оксидов.
Оксиды: основные оксиды, кислотные оксиды, амфотерные оксиды:
Оксид (именуемые также окисел, окись) – это бинарное соединение химического элемента с кислородом в степени окисления −2, в котором сам кислород связан только с менее электроотрицательным элементом.
Химический элемент кислород по электроотрицательности находится на втором месте после фтора, поэтому к оксидам относятся почти все соединения химических элементов с кислородом. Исключение составляет, например, дифторид кислорода OF2.
В зависимости от химических свойств различают:
— солеобразующие оксиды:
- основные оксиды. К ним относятся оксиды металлов, степень окисления которых +1, + 2;
- кислотные оксиды. К ним относятся оксиды металлов со степенью окисления +5, + 6, + 7, и оксиды неметаллов;
- амфотерные оксиды. К ним относятся оксиды металлов со степенью окисления +3, +4, и оксиды-исключения: ZnO, BeO, SnO, PbO;
— несолеобразующие оксиды: оксид углерода (II) СО, оксид азота (I) N2O, оксид азота (II) NO, оксид кремния (II) SiO и оксид серы (II) SO.
В зависимости от количества атомов элементов в оксиде, кроме кислорода различают:
— простые, включающие в молекулу атомы одного элемента, кроме кислорода, и находящихся в в одной степени окисления. Например, оксид лития Li2O.
— сложные оксиды, включающие в молекулу атомы двух и более элементов, кроме кислорода. Например, оксид лития-кобальта (III) Li2O·Co2O3;
— двойные оксиды, в которые атомы одного и того же элемента входят в двух или более степенях окисления. Например, оксид марганца (II, IV) Mn5O8. Во многих случаях такие оксиды могут рассматриваться как соли кислородсодержащих кислот.
Таблица оксидов (1 часть):
| Атомный номер | Химический элемент | Символ | Оксиды |
| 1 | Водород | H | H2O (вода) |
| 2 | Гелий | He | нет |
| 3 | Литий | Li | Li2O (оксид лития) |
| 4 | Бериллий | Be | BeO (оксид бериллия) |
| 5 | Бор | B | B2O3 (оксид бора (III)) |
| 6 | Углерод | C | CO (оксид углерода (II), монооксид углерода, угарный газ),
CO2 (оксид углерода (IV), диоксид углерода, углекислый газ), C3O2 (диоксид триуглерода), (C3O2)n (политрикарбодиоксид), C5O2 (1,2,3,4-пентатетраен-1,5-дион), C6O6 (диангидрид этилентетракарбоновой кислоты) C12O9 (меллитовый ангидрид), C12O12 (гексагидроксибензол трисоксалат), и др. |
| 7 | Азот | N | N2O (оксид азота (I), закись азота, оксонитрид азота, веселящий газ),
NO (оксид азота (II), мон(о)оксид азота, окись азота, нитрозил-радикал), N2O3 (оксид азота (III), азотистый ангидрид, сесквиоксид азота), NO2 (диоксид азота, оксид азота (IV), двуокись азота), N2O5 (оксид азота (V), пентаоксид азота, пентаоксид диазота, нитрат нитрила, нитрат нитрония, азотный ангидрид), N2O4 (димер диоксида азота, тетраоксид диазота, азотный тетраоксид), и др. |
| 8 | Кислород | O | — |
| 9 | Фтор | F | нет |
| 10 | Неон | Ne | нет |
| 11 | Натрий | Na | Na2O (оксид натрия) |
| 12 | Магний | Mg | MgO (оксид магния) |
| 13 | Алюминий | Al | Al2O3 (оксид алюминия) |
| 14 | Кремний | Si | SiO (оксид кремния (II), монооксид кремния),
SiO2 (оксид кремния (IV), диоксид кремния, кремнезём) |
| 15 | Фосфор | P | P4O (монооксид тетрафосфора),
P4O2 (диоксид тетрафосфора), P2O3 или P4O6 (оксид фосфора (III), фосфористый ангидрид, гексаоксид тетрафосфора), P4O8 (оксид фосфора (IV), октаоксид тетрафосфора), P2O5 или P4O10 (оксид фосфора (V), пентаоксид фосфора, фосфористый ангидрид, гексаоксид тетрафосфора) |
| 16 | Сера | S | SO (оксид серы (II), монооксид серы, моноокись серы),
SO2 (оксид серы (IV), диоксид серы, двуокись серы, сернистый газ, сернистый ангидрид), SO3 (оксид серы (VI), трёхокись серы, серный газ, ангидрид серной кислоты) |
| 17 | Хлор | Cl | Cl2O (оксид хлора (I), гемиоксид хлора, ангидрид хлорноватистой кислоты),
ClO2 (диоксид хлора, оксид хлора (IV), двуокись хлора), ClOClO3 (перхлорат хлора ), Cl2O6 (дихлоргексаоксид, оксид хлора (V, VII), перхлорат хлорила), Cl2O7 (оксид хлора (VII), дихлорогептаоксид, хлорный ангидрид), и др. |
| 18 | Аргон | Ar | нет |
| 19 | Калий | K | K2O (оксид калия) |
| 20 | Кальций | Ca | CaO (оксид кальция, окись кальция, негашёная известь, в просторечии — кирабит, кипелка) |
| 21 | Скандий | Sc | Sc2O3 (оксид скандия, сесквиоксид скандия) |
| 22 | Титан | Ti | TiO (оксид титана (II)),
Ti2O3 (оксид титана(III), трёхокись титана), TiO2 (оксид титана (IV), диоксид титана, двуокись титана, титановые белила) |
| 23 | Ванадий | V | VO (оксид ванадия (II), окись ванадия),
V2O3 (оксид ванадия (III), трехокись ванадия), VO2 (оксид ванадия (IV), диоксид ванадия, двуокись ванадия), V2O5 (оксид ванадия (V), пентаоксид диванадия) |
| 24 | Хром | Cr | CrO (оксид хрома (II), закись хрома),
Cr2O3 (оксид хрoма (III), сесквиоксид хрома, хромовая зелень, эсколаит), CrO2 (оксид хрома (IV), диоксид хрома, двуокись хрома), CrO3 (оксид хрома (VI), триоксид хрома, трёхокись хрома, хромовый ангидрид) |
| 25 | Марганец | Mn | MnO (оксид марганца (II), окись марганца, монооксид марганца),
Mn3O4 (оксид марганца (II,III), окисел марганца), Mn5O8 (оксид марганца (II,IV), окисел марганца), Mn2O3 (оксид марганца (III), окисел марганца), MnO2 (оксид марганца (IV), диоксид марганца), MnO3 (оксид марганца (VI), окисел марганца), Mn2O7 (оксид марганца (VII)) |
| 26 | Железо | Fe | FeO (оксид железа (II), закись железа),
Fe2O3 (оксид железа (III), окись железа, колькотар, крокус, железный сурик, гематит), Fe3O4 (оксид железа (II,III), закись-окись железа, железная окалина, магнетит, магнитный железняк), и др. |
| 27 | Кобальт | Co | CoO (оксид кобальта (II), окись кобальта),
Co3O4 (оксид кобальта (II,III), окись кобальта), Co2O3 (оксид кобальта (III), окись кобальта), CoO2•H2O (оксид кобальта (IV), гидрат оксида кобальта) |
| 28 | Никель | Ni | NiO (оксид никеля (II), окись никеля, бунзенит),
Ni2O3 (оксид никеля (III), окисел никеля; сесквиоксид никеля) |
| 29 | Медь | Cu | Cu2O (оксид меди (I), гемиоксид меди, оксид димеди, закись меди, куприт),
CuO (оксид меди (II), окись меди), Cu2O3 (оксид меди (III), триоксид димеди) |
| 30 | Цинк | Zn | ZnO (оксид цинка, окись цинка) |
| 31 | Галлий | Ga | Ga2O (оксид галлия (I), закись галлия, гемиоксид галлия),
Ga2O3 (оксид галлия (III)) |
| 32 | Германий | Ge | GeO (оксид германия (II), окись германия),
GeO2 (оксид германия (IV), диоксид германия, двуокись германия) |
| 33 | Мышьяк | As | As2O3 (оксид мышьяка (III), триоксид мышьяка),
As2O5 (оксид мышьяка (V), пентоксид мышьяка) |
| 34 | Селен | Se | SeO2 (оксид селена (IV), диоксид селена, двуокись селена, доунеит, селенолит),
SeO3 (оксид селена (VI), триоксид селена, селеновый ангидрид) |
| 35 | Бром | Br | Br2O (оксид брома, оксид брома (I), окись брома, ангидрид бромноватистой кислоты) |
Таблица оксидов (2 часть):
| 36 | Криптон | Kr | нет |
| 37 | Рубидий | Rb | Rb2O (оксид рубидия, окись рубидия) |
| 38 | Стронций | Sr | SrO (оксид стронция, окись стронция) |
| 39 | Иттрий | Y | Y2O3 (оксид иттрия, сесквиоксид иттрия) |
| 40 | Цирконий | Zr | ZrO2 (оксид циркония (IV), оксид циркония, диоксид циркония) |
| 41 | Ниобий | Nb | NbO (оксид ниобия (II), окись ниобия),
Nb2O3 (оксид ниобия (III), окись ниобия), NbO2 (оксид ниобия (IV), окись ниобия), Nb2O5 (оксид ниобия (V), окись ниобия) |
| 42 | Молибден | Mo | Mo2O3 (оксид молибдена (III), окись молибдена),
MoO2 (оксид молибдена (IV), окись молибдена), Mo2O5 (оксид молибдена (V), окись молибдена), MoO3 (оксид молибдена (VI), триоксид молибдена, триоксомолибден, молибдит) |
| 43 | Технеций | Tc | TcO2 (оксид технеция (IV), окись технеция (IV)),
Tc2O7 (оксид технеция (VII), окись технеция (VII)) |
| 44 | Рутений | Ru | Ru2O3 (оксид рутения (III), окись рутения (III), сесквиоксид рутения),
RuO2 (оксид рутения(IV), окись рутения (IV)), RuO4 (оксид рутения(VIII), тетраоксид рутения) |
| 45 | Родий | Rh | RhO (оксид родия (II), окисел родия),
Rh2O3 (оксид родия (III), сесквиоксид родия), RhO2 (оксид родия (IV), окисел родия) |
| 46 | Палладий | Pd | PdO (оксид палладия (II), окись палладия),
Pd2O3•n H2O (оксид палладия (III), окисел палладия), PdO2 (оксид палладия (IV), окисел палладия) |
| 47 | Серебро | Ag | Ag2O (оксид серебра (I)),
Ag+1Ag+3O2 или Ag2O2 (оксид серебра (I,III), оксид серебра (III)-серебра (I), монооксид серебра, диоксид дисеребра) |
| 48 | Кадмий | Cd | Cd2O (оксид кадмия (I)),
CdO (оксид кадмия (II)) |
| 49 | Индий | In | In2O (оксид индия (I), окись индия (I), гемиоксид индия, закись индия),
InO (оксид индия (II), окись индия (II)), In2O3 (оксид индия (III)) |
| 50 | Олово | Sn | SnO (оксид олова (I), монооксид олова, олово окись (II), олово закись, олово одноокись),
SnO2 (оксид олова (IV), окись олова, двуокись олова, диоксид олова, касситерит), Sn3O4 |
| 51 | Сурьма | Sb | Sb2O3 (оксид сурьмы (III), сесквиоксид сурьмы, сурьмянистый ангидрид),
Sb2O5 (оксид сурьмы (V), пятиокись сурьмы, сурмяный ангидрид), Sb2O4 или SbIIISbVO4 (тетраоксид сурьмы, диоксид сурьмы) |
| 52 | Теллур | Te | TeO2 (оксид теллура (IV), диоксид теллура, теллурит, двуокись теллура, ангидрид теллуристой кислоты),
TeO3 (оксид теллура (VI), триоксид теллура, трёхокись теллура, ангидрид теллуровой кислоты), Te2O5, Te4O9 |
| 53 | Йод | I | I+12O (монооксид дийода),
I+2O (монооксид йода), I+4O2 (диоксид йода), I+3, +52O4 или I+3O(I+5O3) или (I+3, +5O2)2 (тетраоксид дийода, иодноватокислый йод), I+52O5 или O(IO2)2 (оксид йода (V), пентаоксид дийода, иодноватый ангидрид), I+3, +54O9 или I+3(I+5O3)3 или I+3(OI+5O2)3 (иодат йода (III), иодноватокислый йод, нонаоксид тетрайода) |
| 54 | Ксенон | Xe | XeO2 (оксид ксенона (IV), диоксид ксенона),
XeO3 (триоксид ксенона), XeO4 (тетраоксид ксенона) |
| 55 | Цезий | Cs | Cs2O (оксид цезия, окись цезия) |
| 56 | Барий | Ba | BaO (оксид бария, окись бария, безводный барит) |
| 57 | Лантан | La | La2O3 (оксид лантана (III), сесквиоксид лантана) |
| 58 | Церий | Ce | Ce2O3 (оксид церия (III)),
CeO2 (оксид церия (IV), диоксид церия, двуокись церия) |
| 59 | Празеодим | Pr | PrO (оксид празеодима (II), монооксид празеодима),
Pr2O3 (оксид празеодима (III), сесквиоксид празеодима), PrO2 (оксид празеодима (IV), окись празеодима), Pr6O11 (оксид празеодима (III, IV), ундекаоксид гексапразеодима) |
| 60 | Неодим | Nd | NdO (оксид неодима (II), окисел неодима),
Nd2O3 (оксид неодима (III), сесквиоксид неодима) |
| 61 | Прометий | Pm | Pm2O3 (оксид прометия (III), сесквиоксид прометия) |
| 62 | Самарий | Sm | SmO (оксид самария (II), монооксид самария, окись самария),
Sm2O3 (оксид самария (III), сесквиоксид самария, окись самария) |
| 63 | Европий | Eu | EuO (оксид европия (II), монооксид европия, окись европия),
Eu3O4 или или EuO•Eu2O3 (оксид европия (II,III)), Eu2O3 (оксид европия (III)) |
| 64 | Гадолиний | Gd | Gd2O3 (оксид гадолиния (III), окись гадолиния) |
| 65 | Тербий | Tb | Tb2O3 (оксид тербия (III), трехокись тербия, триоксид тербия),
Tb4O7 (оксид тербия (III, IV), гептаоксид тетратербия), TbO2 (оксид тербия (IV), диоксид тербия), Tb6O11 |
| 66 | Диспрозий | Dy | Dy2O3 (оксид диспрозия (III), окись диспрозия, триоксид диспрозия) |
| 67 | Гольмий | Ho | Ho2O3 (оксид гольмия (III), окись гольмия) |
| 68 | Эрбий | Er | Er2O3 (оксид эрбия (III), окись эрбия, триоксид эрбия) |
| 69 | Тулий | Tm | Tm2O3 (оксид тулия (III), сесквиоксид тулия) |
| 70 | Иттербий | Yb | Yb2O3 (оксид иттербия (III), окись иттербия , сесквиоксид иттербия) |
Таблица оксидов (3 часть):
| 71 | Лютеций | Lu | Lu2O3 (оксид лютеция (III), окисел лютеция) |
| 72 | Гафний | Hf | HfO2 (оксид гафния (IV), окись гафния) |
| 73 | Тантал | Ta | Ta2O (оксид тантала (I), закись тантала),
TaO (оксид тантала (II), окись тантала), TaO2 (оксид тантала (IV), окись тантала), Ta2O5 (оксид тантала (V), окись тантала, пентаоксид тантала) |
| 74 | Вольфрам | W | WO2 (оксид вольфрама (IV), окись вольфрама, двуокись вольфрама, диоксид вольфрама),
WO3 (оксид вольфрама (VI), триоксид вольфрама, трёхокись вольфрама, вольфрамовый ангидрид, ангидрид вольфрамовой кислоты) |
| 75 | Рений | Re | Re2O (оксид рения (I), окись рения),
ReO (оксид рения (II), окись рения), Re2O3 (оксид рения (III), окисел рения), ReO2 (оксид рения (IV), окись рения (IV)), Re2O5 (оксид рения (V), окисел рения), ReO3 (оксид рения (VI), окись рения (VI)), Re2O7 (оксид рения (VII), окись рения (VII), рениевый ангидрид) |
| 76 | Осмий | Os | |
| 77 | Иридий | Ir | |
| 78 | Платина | Pt | |
| 79 | Золото | Au | |
| 80 | Ртуть | Hg | |
| 81 | Таллий | Tl | |
| 82 | Свинец | Pb | |
| 83 | Висмут | Bi | |
| 84 | Полоний | Po | |
| 85 | Астат | At | |
| 86 | Радон | Rn | |
| 87 | Франций | Fr | |
| 88 | Радий | Ra | |
| 89 | Актиний | Ac | |
| 90 | Торий | Th | |
| 91 | Протактиний | Pa | |
| 92 | Уран | U | |
| 93 | Нептуний | Np | |
| 94 | Плутоний | Pu | |
| 95 | Америций | Am | |
| 96 | Кюрий | Cm | |
| 97 | Берклий | Bk | |
| 98 | Калифорний | Cf | |
| 99 | Эйнштейний | Es | |
| 100 | Фермий | Fm | |
| 101 | Менделевий | Md | |
| 102 | Нобелий | No | |
| 103 | Лоуренсий | Lr | |
| 104 | Резерфордий (Курчатовий) | Rf | |
| 105 | Дубний (Нильсборий) | Db | |
| 106 | Сиборгий | Sg | |
| 107 | Борий | Bh | |
| 108 | Хассий | Hs | |
| 109 | Мейтнерий | Mt | |
| 110 | Дармштадтий | Ds |
Коэффициент востребованности
27 597
Руда — основной источник сырья в металлургии. Это естественная форма металла, только в окисленном виде. Форма эта называется оксидом и присуща многим металлам. Вот чем объясняется такое явление как коррозия. Это не что иное, как стремление металла к своему естественному состоянию.
Оксиды металлов представляют лишь часть природных соединений, к которым также относятся вода, песок, глина и углекислый газ. Да, первичной материей был именно оксид — бинарное соединение, образующееся при окислении простого вещества.
Что такое «оксиды металлов»
Если говорить просто, то оксид металла — это соединение химического элемента с кислородом. Но здесь есть нюанс, ведь кислород вхож во многие соединения. Оксиды отличаются от других соединений тем, что в них кислород соединён всего с одним элементом. Если этих элементов будет два или три, то речь пойдёт совсем о другом веществе.
Ряд оксидов настолько широк, что изучение химии без него станет практически невозможным. Банальный пример — вода, участвующая в большинстве химических реакций.
Все оксиды классифицируются по видам. Оксиды металлов представляют отдельный вид, который подчиняется общим законам. Кислород присутствует здесь априори, но второй составляющей непременно будет металл, определяющий принадлежность к конкретной группе. Иногда один химический элемент способен образовать несколько оксидов. В качестве примера можно привести медную руду Cu2O.
Какие оксиды бывают у металлов
Да, существуют разные виды оксидов, поскольку кислород способен соединяться не только с металлами. Но, в отличие от неметаллов, оксиды металлов всегда представляют собой твёрдое вещество. Соединения с одинаковыми химическими элементами могут отличаться, что объясняется переменной валентностью, которая обязательно указывается в названии химического вещества. Это можно проследить по формулам оксидов металла (в скобках указана валентность):
- Cr2O3 – оксид хрома (III);
- CrO3 – оксид хрома (VI).
Определить валентность можно с помощью таблицы Менделеева.
Итак, большинство минералов представляют собой именно оксиды. Это всем известные железные руды: красный, магнитный или бурый железняк, а также алюминиевая руда боксит. Чтобы получить чистый металл, руду подвергают процессу восстановления.
Ряд оксидов широк и неоднороден. Разобраться в нём помогает классификация, образующая стройный ряд всех видов.
Классификация, получение, физические и химические свойства
Классификация принципиально базируется на химических свойствах этих веществ. Первое деление выделяет две основные группы — солеобразующие и несолеобразующие. Второй вид образует группу, в которую входят преимущественно оксиды неметаллов. Эти вещества не образуют солей и не взаимодействуют с кислотами и щелочами.
Группа солеобразующая гораздо шире, поскольку здесь уже присутствуют металлы. Эта группа также делится на отдельные виды:
- основные оксиды металла, взаимодействующие с кислотами и образующие соли;
- кислотные; взаимодействующие с основаниями и также образующие соли
- амфотерные, взаимодействующие с кислотами и щелочами.
К основным относятся оксиды металлов со степенью окисления I-II (Na2O, CuO). К кислотным — со степенью окисления V-VII. К амфотерным — со степенью окисления III-IV. В последнем случае могут быть исключения.
Существует несколько способов получения таких соединений. В общей сложности их насчитывают около десяти. Основные из них приведены в таблице.
|
Метод |
Химические элементы |
Результат |
|
Взаимодействие простых веществ с кислородом |
2Mg + O2 (магний + кислород) |
2MgO (оксид магния) |
|
Обжиг в кислороде |
2ZnS + 3O2 (сульфид цинка + кислород) |
2ZnO + 2SO2 (оксид цинка + оксид серы) |
|
Разложение солей, кислот или оснований под воздействием высоких температур |
2FeSO4 (сульфат железа) |
Fe2O3 + SO2 + SO3 (оксид железа + двуокись серы + трёхокись серы) |
|
Метод восстановления или окисления низших форм в высшие и наоборот |
4FeO + O2 (оксид железа II +кислород) |
2Fe2O3 (оксид железа III) |
|
Взаимодействие металлов с водой при высоких температурах |
Zn + H2O (цинк + вода) |
ZnO + H2 (оксид цинка + водород) |
|
Взаимодействие металлов с кислотами |
Zn + 4HNO3 (цинк + азотная кислота) |
Zn(NO3)2 + 2NO2 +2H2O (нитрат цинка + оксид азота + вода) |
|
Воздействие на соли и кислоты водоотнимающих веществ |
NaHCO3 + HCl (гидрокарбонат натрия + соляная кислота) |
NaCl + H2O + CO2 (хлорид натрия + вода + углекислый газ) |
В соответствии с химической номенклатурой, оксиды могут менять наименования в зависимости от степени окисления или числа атомов кислорода. Так появились названия монооксид, диоксид, триоксид. Соединения с низшими степенями окисления называют закисью, а оксиды металла с высшими степенями — окисью.
Химические реакции, в которые вовлечён кислород, позволяют получать новые виды оксидов. За основу берут не только отдельные элементы или химические соединения, но и известные формы оксидов. Для изобретений используют те же методы, которые были перечислены выше.
Физические и химические свойства
Оксид металла представляет собой твёрдое кристаллическое вещество с характерным цветом: красно-коричневый (железо), чёрный (медь), белый (магний), тёмно-зелёный (хром). Все эти вещества не растворяются в воде.
Для каждого вида характерны и свои химические свойства. Так, основные оксиды металлов способны взаимодействовать с кислотами, а кислотные с основаниями. Эти характеристики важны не только при восстановлении. Многие из этих соединений способны вступать в реакцию с водой, хотя далеко не все растворяются в ней. Последняя характеристика невероятно ценна в практическом отношении. В качестве примера можно привести цинковые и титановые белила, основу которых составляют оксиды ZnO и TiO2. Или, например, оксид титана и хрома.
Если говорить об оксиде титана, то он не растворяется не только в воде, но и в кислой среде, что значительно расширяет сферу его применения. Способность не растворяться позволяет использовать эти вещества в качестве пигментов для красок разного уровня и назначения (художественные, эмалированные, для гравюры и т. д.).
Применение оксидов металла в металлургии
Получение и производство разных видов металла — основа металлургии. Поскольку большая часть природных металлов представляет собой определённую форму оксида, то восстановление и есть первая задача металлургии. Для этого используют все существующие методы восстановления. В зависимости от метода металлургия приобретает более узкое название:
- пирометаллургия, использующая высокие температуры и ряд восстановителей — кокс, водород, кремний, углерод и активные металлы;
- гидрометаллургия, где природным соединениям придают растворимую форму, восстанавливая металл из полученного раствора. Впервые об этом методе упоминал в своих трудах М. В. Ломоносов. Метод очень интересный, поскольку позволяет получить металл даже из руды с низким содержанием необходимого химического элемента;
- электрометаллургия, использующая электролиз;
- биометаллургия, использующая биохимические процессы. Метод постепенно становится очень популярным. Таким образом можно получать медь, серебро, никель, уран и целый ряд редких металлов.
В отдельный раздел можно вывести историю получения алюминия из глинозёма, который также представляет собой оксид металла. Это направление остаётся актуальным даже сегодня, хотя появилось более ста лет назад. Да, история алюминия невероятно интересна. Сегодня его получают разными методами, хотя в приоритете по-прежнему остаётся метод электролиза.
- Оксиды металлов
-
«…Оксиды металлов — это соединения металлов с кислородом. Многие из них могут соединяться с одной или несколькими молекулами воды с образованием гидроксидов.
Большинство оксидов являются основными, так как их гидроксиды ведут себя как основания. Однако некоторые оксиды (кислотные оксиды, или ангидриды) образуют соли только в реакциях со щелочами или другими основаниями, в то же время достаточно распространенным классом оксидов являются амфотерные оксиды, которые проявляют как кислотные, так и основные свойства. Эти два последних класса оксидов должны рассматриваться как оксиды, или ангидриды, кислот, реальных или гипотетических, соответствующих их гидроксидам.
Некоторые оксиды (солеподобные) можно рассматривать как результат взаимодействия основного оксида с кислотным оксидом…»
Источник:
«Пояснения к Товарной номенклатуре внешнеэкономической деятельности Российской Федерации (ТН ВЭД России)» (подготовлены ГТК РФ) (том 1, разделы I — VI, группы 1 — 29)
Официальная терминология.
Академик.ру.
2012.
Смотреть что такое «Оксиды металлов» в других словарях:
-
Оксиды — Оксид (окисел, окись) бинарное соединение химического элемента с кислородом в степени окисления −2, в котором сам кислород связан только с менее электроотрицательным элементом. Химический элемент кислород по электроотрицательности второй… … Википедия
-
оксиды — Соединение химического элемента с кислородом. По химическим свойствам все оксиды делятся на солеобразующие (наприме, Na2О, MgO, Al2O3, SiO2, P2O5, SO3, Cl2O7) и несолеобразующие (например, СО, N2O, NO, H2O). Солеобразующие оксиды подразделяют на… … Справочник технического переводчика
-
ОКСИДЫ ПРИРОДНЫЕ — (окислы природные) класс минералов, природные химические соединения элементов, в основном металлов, с кислородом (простые и сложные оксиды природные) или с гидроксильной группой (гидроксиды природные), с O2 и OH (оксигидраты). Ок. 300 минералов.… … Большой Энциклопедический словарь
-
Оксиды — (окислы) – химическое соединение металлов с кислородом. [Блюм Э. Э. Словарь основных металловедческих терминов. Екатеринбург, 2002 г.] Оксиды – класс химических соединений элементов с кислородом. [Ушеров Маршак А. В. Бетоноведение:… … Энциклопедия терминов, определений и пояснений строительных материалов
-
оксиды природные — (окислы природные), класс минералов, природные химические соединения элементов, в основном металлов, с кислородом (простые и сложные оксиды природные) или с гидроксильной группой (гидроксиды природные), с O2 и ОН (оксигидраты). Около… … Энциклопедический словарь
-
ОКСИДЫ — соединения элементов с кислородом. В О. степень окисления атома кислорода Ч2. К О. относятся все соед. элементов с кислородом, кроме содержащих атомы О, соединенные друг с другом (пероксиды, надпероксиды, озо ниды), и соед. фтора с кислородом… … Химическая энциклопедия
-
Оксиды углерода — Оксиды углерода бинарные химические соединения (оксиды) углерода с кислородом. Список оксидов углерода Наиболее известны три оксида углерода: Монооксид углерода CO Диоксид углерода CO2 Диоксид триуглерода C3O2 Существует ряд менее известных … Википедия
-
Оксиды — [oxides] соединение химического элемента с кислородом. По химическим свойствам все оксиды делятся на солеобразующие (например, Na2O, MgO, Al2O3, SiO2, P2O5, SO3, Cl2O7) и несолеобразующие (например, СО, N2O, NO, H2O). Солеобразующие оксиды… … Энциклопедический словарь по металлургии
-
ОКСИДЫ, ОКИСЛЫ — соединения химических элементов с кислородом. По химическим свойствам все оксиды, окислы подразделяют на солеобразующие и несолеобразующие. Солеобразующие оксиды, окислы подразделяют на основные, кислотные и амфотерные (их гидрооксиды являются… … Металлургический словарь
-
ОКСИДЫ — окиси, окислы, соединения хим. элементов с кислородом. По хим. св вам все О. делятся на солеобразующие и несолеобразующие. Солеобразующие О. подразделяются на основные, кислотные и амфотерные (продукты их взаимодействия с водой являются… … Большой энциклопедический политехнический словарь
Вот парочка примеров а дальше всё равно почитайте
ClO2 — кислотный оксид
2 ClO2 + H2O —> HClO2 + HClO3
2 ClO2 + 2 KOH —> KClO2 + KClO3
Ba(OH)2
ВаО — основной оксид
BaO + H2O —> Ba(OH)2
BaO + 2 HCl —> BaCl2 + H2O
BaO + CO2 —> BaCO3
Оксиды – соединения атомов двух элементов, один из которых кислород в степени окисления –2.
В оксидах атомы кислорода связаны только с атомами другого элемента и не связаны друг с другом. Соединения, содержащие в своем составе непосредственно связанные друг с другом атомы кислорода (–О–О–), называют пероксидами.
Не образуют оксидов только Hе, Ne, Аr и F. Различают высшие оксиды, в которых атом элемента проявляет высшую степень окисления (обычно равна номеру группы, в которой находится элемент) , и низшие оксиды – те, в которых атом элемента проявляет низшую степень окисления. Оксиды, содержащие атомы элемента в разных степенях окисления, называют двойными, например:
Fe3O4 FeO•Fe2O3, Mn3O4 MnO•Mn2O3, Pb2O3 PbO•PbO2.
По химическим свойствам оксиды делятся на солеобразующие (образуют соли при взаимодействии с кислотами и/или щелочами) и несолеобразующие (не образуют солей, безразличны к кислотам и щелочам; к ним относятся СO, NO, N2O, SiO, S2O).
Многие солеобразующие оксиды присоединяют воду. Этот процесс называется гидратацией, а его продукты – гидратами оксидов, или гидроксидами (содержат одну или несколько гидроксигрупп –ОН) .
Некоторые оксиды с водой не взаимодействуют, их гидроксиды можно получить косвенным путем.
Оксид и гидроксид соответствуют друг другу, если содержат один и тот же элемент с одной и той же степенью окисления атома.
Солеобразующие оксиды разделяют на основные, кислотные и амфотерные в зависимости от типа соответствующего гидроксида. Kислотно-основные свойства родственных оксидов и гидроксидов (Na2O и NaOH, SO3 и H2SO4) cовпадают.
Основными называют оксиды, которым соответствуют гидроксиды – основания.
Kислотными называют оксиды, которым соответствуют гидроксиды – кислоты.
Амфотерными называют оксиды, которым соответствуют амфотерные гидроксиды.
Неметаллы образуют только кислотные и несолеобразующие оксиды; металлы образуют все основные, все амфотерные и некоторые кислотные оксиды. Многие металлы побочных подгрупп, имеющие в соединениях переменную с. о. атомов, могут образовывать несколько оксидов и гидроксидов, характер которых зависит от с. о. атома элемента. С ростом степени окисления атома элемента его электроотрицательность растет. Соответственно растут неметаллические свойства элемента, а также кислотные свойства его оксида и гидроксида.
Оксиды металлов в с. о. атомов +1 (Na2O, K2O и др.) , а также большинство оксидов металлов в с. о. атомов +2 (FeO, MgO и др. ) являются основными. Исключения: BeO, ZnO, PbO, SnO – амфотерные. Большинство оксидов металлов в с. о. атомов +3 и +4 – амфотерные (Al2O3, Cr2O3, Fe2O3, SnO2, PbO2 и др.) . Оксиды металлов в с. о. атомов +5, +6, +7, +8 – кислотные (Mn2O7, CrO3, Sb2O5 и др. )
Посмотрите схему
Ответ:
Правильное написание слова — оксид
Значение слова -== окисел
Выберите, на какой слог падает ударение в слове — НОВОРОЖДЁННЫЙ ?
или
Слово состоит из букв:
О,
К,
С,
И,
Д,
Похожие слова:
антиоксидант
дезоксидация
оксидация
оксидиметрия
оксидировавший
оксидировавшийся
оксидирование
оксидированный
оксидировать
оксидировка
Рифма к слову оксид
пирамид, мадрид, обид, вид
Толкование слова. Правильное произношение слова. Значение слова.
Окси́д (о́кисел, о́кись) — соединение химического элемента с кислородом, в котором сам кислород связан только с менее электроотрицательным элементом. Химический элемент кислород по электроотрицательности второй после фтора, поэтому к оксидам относятся почти все соединения химических элементов с кислородом. К исключениям относятся, например, дифторид кислорода OF2.
Оксиды — весьма распространенный тип соединений, содержащихся в земной коре и во вселенной вообще. Примерами таких соединений являются ржавчина, вода, песок, углекислый газ, ряд красителей. Окислами называется класс минералов, представляющих собой соединения металла с кислородом (см. Категория:Окислы).
Соединения, содержащие атомы кислорода, соединённые между собой, называются пероксидами (перекисями) и супероксидами. Они не относятся к категории оксидов.
Содержание
- 1 Классификация
- 2 Номенклатура
- 3 Химические свойства: Основные оксиды.
- 4 Химические свойства: Кислотные оксиды.
- 5 Химические свойства: Амфотерные оксиды.
- 6 Получение оксидов
- 7 Ссылки
Классификация
В зависимости от химических свойств различают:
- солеобразующие оксиды
- основные оксиды (например, оксид натрия Na2O, оксид меди(II) CuO); Оксиды металлов, валентность которых I-II, кроме ZnO.
- кислотные оксиды (например, оксид серы(VI) SO3, оксид азота(IV) NO2); Оксиды металлов с валентностью V-VII и оксиды неметаллов.
- амфотерные оксиды (например, оксид цинка ZnO, оксид алюминия Al2О3); Оксиды металлов с валентностью III-IV и ZnO.
- Несолеобразующие оксиды (например, оксид углерода(II) СО, оксид азота(I) N2O, оксид азота(II) NO, оксид кремния(II) SiO).
Номенклатура
В соответствии с номенклатурой ИЮПАК, оксиды называют словом «оксид», после которого следует наименование химического элемента в родительном падеже, например: Na2O — оксид натрия, Al2O3 — оксид алюминия. Если элемент образует несколько оксидов, то в их названиях указывается его степень окисления римской цифрой в скобках сразу после названия (без пробела). Например, Cu2О — оксид меди(I), CuO — оксид меди(II), FeO — оксид железа(II), Fe2О3 — оксид железа(III), Cl2O7 — оксид хлора(VII).
Часто используют и другие наименования оксидов по числу атомов кислорода: если оксид содержит только один атом кислорода, то его называют монооксидом, моноокисью или закисью, если два — диоксидом или двуокисью, если три — то триоксидом или триокисью и т. д. Например: монооксид углерода CO, диоксид углерода СО2, триоксид серы SO3.
Также распостранены исторически сложившиеся (тривиальные) названия оксидов, например угарный газ CO, серный ангидрид SO3 и т. д.
Химические свойства: Основные оксиды.
1. Основный оксид + кислота = соль + вода
CuO + H2SO4 = CuSO4 + H2O
Примечание:кислота ортофосфорная или сильная.
2. Сильноосновный оксид + вода = щелочь
CaO + H2O = Ca(OH)2
3. Сильноосновный оксид + кислотный оксид = соль
CaO + Mn2O7 = Ca(MnO4)2
Na2O + CO2 = Na2СO3
4. Основный оксид + водород = металл + вода
CuO + H2 = Cu + H2O
Примечание: металл менее активный, чем алюминий.
Химические свойства: Кислотные оксиды.
1. Кислотный оксид + вода = кислота
SO3 + H2O = H2SO4
Некоторые оксиды, например SiO2, с водой не реагируют, поэтому их кислоты получают косвенным.
2. Кислотный оксид + основной оксид = соль
CO2 + CaO = CaCO3
3. Кислотный оксид + основание = соль + вода
SO2 + 2NaOH = Na2SO3 + H2O
Если кислотный оксид является ангидридом многоосновной кислоты, возможно образование кислых или средних солей:
Ca(OH)2 + CO2 = CaCO3↓ + H2O
CaCO3 + CO2 + H2O = Ca(HCO3)2
4. Нелетучий оксид + соль1 = соль2 + летучий оксид
SiO2 + Na2CO3 = Na2SiO3 + CO2↑
Химические свойства: Амфотерные оксиды.
При взаимодействии с сильной кислотой или кислотным оксидом проявляют основные свойства:
ZnO + 2HCl = ZnCl2 + H2O
При взаимодействии с сильным основанием или основным оксидом проявляют кислотные свойства:
ZnO + 2KOH + H2O = K2[Zn(OH)4)] (в водном растворе)
ZnO + CaO = CaZnO2 (при сплавлении)
Получение оксидов
1. Взаимодействие простых веществ (за исключением инертных газов, золота и платины) с кислородом:
2H2 + O2 = 2H2O
2Сu + O2 = 2СuO
При горении в кислороде щелочных металлов (кроме лития), а также стронция и бария образуются пероксиды и надпероксиды:
2Na + O2 = Na2O2
K + O2 = KO2
2. Обжиг или горение бинарных соединений в кислороде:
4FeS2 + 11O2 = 2Fe2O3 + 8SO2↑
CS2 + 3O2 = CO2 + 2SO2
2PH3 + 4O2 = P2O5 + 3H2O
3. Термическое разложение солей:
CaCO3 = CaO + CO2↑
2FeSO4 = Fe2O3 + SO2↑ + SO3↑
4. Термическое разложение оснований или кислот:
2Al(OH)3 = Al2O3 + 3H2O↑
4HNO3 = 4NO2↑ + O2↑ + 2H2O
5. Окисление низших оксидов в высшие и восстановление высших в низшие:
4FeO + O2 = 2Fe2O3
Fe2O3 + CO = 2FeO + CO2↑
6. Взаимодействие некоторых металлов с водой при высокой температуре:
Zn + H2O = ZnO + H2↑
7. Взаимодействие солей с кислотными оксидами при нагревании с выделением летучего оксида:
Ca3(PO4)2 + 3SiO2 = 3CaSiO3 + P2O5↑
8. Взаимодействие металлов с кислотами-оксилителями:
Zn + 4HNO3(конц.) = Zn(NO3)2 + 2NO2↑ + 2H2O
9. При действии водоотнимающих веществ на кислоты и соли:
2KClO4 + H2SO4(конц) = K2SO4 + Cl2O7 + H2O
10. Взаимодействие солей слабых неустойчивых кислот с более сильными кислотами:
NaHCO3 + HCl = NaCl + H2O + CO2↑
Ссылки
- Таблица классификации оксидов
Wikimedia Foundation.
2010.