| Оксид магния | |
|---|---|
 |
|
| Систематическое наименование |
Оксид магния |
| Традиционные названия | Жжёная магнезия, периклаз, асбест |
| Хим. формула | MgO |
| Рац. формула | MgO |
| Состояние | твёрдое |
| Молярная масса | 40,3044 г/моль |
| Плотность | 3,58 г/см³ |
| Т. плав. | 2825 °C |
| Т. кип. | 3600 °C |
| Энтальпия образования | -601,8 кДж/моль |
| Давление пара | 0 ± 1 мм рт.ст. |
| Растворимость в воде | 0,86 г/100 мл |
| ГОСТ | ГОСТ 844-79 ГОСТ 4526-75 |
| Рег. номер CAS | 1309-48-4 |
| PubChem | 14792 |
| Рег. номер EINECS | 215-171-9 |
| SMILES |
O=[Mg] |
| InChI |
1S/Mg.O CPLXHLVBOLITMK-UHFFFAOYSA-N |
| Кодекс Алиментариус | E530 |
| RTECS | OM3850000 |
| ChEBI | 31794 |
| ChemSpider | 14108 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. |
Оксид магния (жжёная магнезия) — химическое соединение с формулой MgO, белые кристаллы, малорастворимые в воде, пожаро- и взрывобезопасен.
Основная форма — минерал периклаз.
Физические свойства
Легкий, рыхлый порошок белого цвета, легко впитывает воду. На этом свойстве основано его применение в спортивной гимнастике: нанесенный на ладони спортсмена, порошок предохраняет его от опасности сорваться с гимнастического снаряда. Температура плавления — 2825 °C. Температура кипения — 3600 °C. Плотность=3,58 г/см3.
Химические свойства
Реагирует с разбавленными кислотами с образованием солей, плохо — с холодной водой, образуя Mg(OH)2:
С горячей водой реагирует лучше, реакция идет быстрее.
-
- MgO + 2HCl → MgCl2 + H2O
-
- MgO + H2O → Mg(OH)2
Получение
Оксид магния получают обжигом минералов магнезита и доломита.
- CaCO3 ∗ MgCO3 → MgO + CaO + 2CO2
- MgCO3 → MgO + CO2
Применение
В промышленности применяется для производства огнеупоров, цементов, очистки нефтепродуктов, как наполнитель при производстве резины, наполнитель в ТЭНах. Сверхлегкий оксид магния применяется как очень мелкий абразив для очистки поверхностей, в частности, в электронной промышленности.
В медицине применяют при повышенной кислотности желудочного сока, так как она обусловливается избыточным содержанием соляной кислоты. Жжёную магнезию принимают также при случайном попадании в желудок кислот.
В пищевой промышленности зарегистрирован в качестве пищевой добавки E530.
Является абсолютным отражателем — веществом с коэффициентом отражения, равным единице в широкой спектральной полосе. Может применяться как доступный эталон белого цвета.
From Wikipedia, the free encyclopedia

|
|

|
|
| Names | |
|---|---|
| IUPAC name
Magnesium oxide |
|
| Other names
Magnesia |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChEMBL |
|
| ChemSpider |
|
| ECHA InfoCard | 100.013.793 |
| EC Number |
|
| E number | E530 (acidity regulators, …) |
| KEGG |
|
|
PubChem CID |
|
| RTECS number |
|
| UNII |
|
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
MgO |
| Molar mass | 40.304 g/mol[1] |
| Appearance | White powder |
| Odor | Odorless |
| Density | 3.6 g/cm3[1] |
| Melting point | 2,852 °C (5,166 °F; 3,125 K)[1] |
| Boiling point | 3,600 °C (6,510 °F; 3,870 K)[1] |
| Solubility | Soluble in acid, ammonia insoluble in alcohol |
| Electrical resistivity | Dielectric[a] |
| Band gap | 7.8 eV[2] |
|
Magnetic susceptibility (χ) |
−10.2·10−6 cm3/mol[3] |
| Thermal conductivity | 45–60 W·m−1·K−1[4] |
|
Refractive index (nD) |
1.7355 |
|
Dipole moment |
6.2 ± 0.6 D |
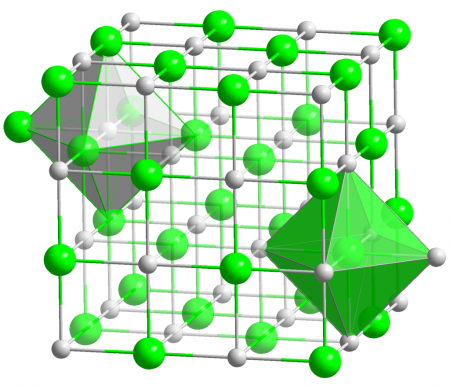
| Structure | |
|
Crystal structure |
Halite (cubic), cF8 |
|
Space group |
Fm3m, No. 225 |
|
Lattice constant |
a = 4.212Å |
|
Coordination geometry |
Octahedral (Mg2+); octahedral (O2−) |
| Thermochemistry | |
|
Heat capacity (C) |
37.2 J/mol K[8] |
|
Std molar |
26.95 ± 0.15 J·mol−1·K−1[9] |
|
Std enthalpy of |
−601.6 ± 0.3 kJ·mol−1[9] |
|
Gibbs free energy (ΔfG⦵) |
-569.3 kJ/mol[8] |
| Pharmacology | |
|
ATC code |
A02AA02 (WHO) A06AD02 (WHO), A12CC10 (WHO) |
| Hazards | |
| Occupational safety and health (OHS/OSH): | |
|
Main hazards |
Metal fume fever, Irritant |
| GHS labelling: | |
|
Pictograms |

|
|
Signal word |
Warning |
|
Hazard statements |
H315, H319, H335 |
|
Precautionary statements |
P261, P264, P271, P273, P280, P302+P352, P304+P340, P305+P351+P338, P312, P333+P313, P337+P313, P362, P363, P391, P403+P233, P405 |
| NFPA 704 (fire diamond) |
1 0 0 |
| Flash point | Non-flammable |
| NIOSH (US health exposure limits): | |
|
PEL (Permissible) |
TWA 15 mg/m3 (fume)[10] |
|
REL (Recommended) |
None designated[10] |
|
IDLH (Immediate danger) |
750 mg/m3 (fume)[10] |
| Safety data sheet (SDS) | ICSC 0504 |
| Related compounds | |
|
Other anions |
Magnesium sulfide |
|
Other cations |
Beryllium oxide Calcium oxide Strontium oxide Barium oxide |
|
Related compounds |
Magnesium hydroxide Magnesium nitride |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Magnesium oxide (MgO), or magnesia, is a white hygroscopic solid mineral that occurs naturally as periclase and is a source of magnesium (see also oxide). It has an empirical formula of MgO and consists of a lattice of Mg2+ ions and O2− ions held together by ionic bonding. Magnesium hydroxide forms in the presence of water (MgO + H2O → Mg(OH)2), but it can be reversed by heating it to remove moisture.
Magnesium oxide was historically known as magnesia alba (literally, the white mineral from Magnesia), to differentiate it from magnesia negra, a black mineral containing what is now known as manganese.
[edit]
While «magnesium oxide» normally refers to MgO, the compound magnesium peroxide MgO2 is also known. According to evolutionary crystal structure prediction,[11] MgO2 is thermodynamically stable at pressures above 116 GPa (gigapascals), and a semiconducting suboxide Mg3O2 is thermodynamically stable above 500 GPa. Because of its stability, MgO is used as a model system for investigating vibrational properties of crystals.[12]
Electric properties[edit]
Pure MgO is not conductive and has a high resistance to electric current at room temperature. The pure powder of MgO has a relative permittivity inbetween 3.2 to 9.9 
Production[edit]
Magnesium oxide is produced by the calcination of magnesium carbonate or magnesium hydroxide. The latter is obtained by the treatment of magnesium chloride MgCl
2 solutions, typically seawater, with limewater or milk of lime.[13]
- Mg2+ + Ca(OH)2 → Mg(OH)2 + Ca2+
Calcining at different temperatures produces magnesium oxide of different reactivity. High temperatures 1500 – 2000 °C diminish the available surface area and produces dead-burned (often called dead burnt) magnesia, an unreactive form used as a refractory. Calcining temperatures 1000 – 1500 °C produce hard-burned magnesia, which has limited reactivity and calcining at lower temperature, (700–1000 °C) produces light-burned magnesia, a reactive form, also known as caustic calcined magnesia. Although some decomposition of the carbonate to oxide occurs at temperatures below 700 °C, the resulting materials appear to reabsorb carbon dioxide from the air.[14]
Applications[edit]
Heating elements[edit]
MgO is prized as a refractory material, i.e. a solid that is physically and chemically stable at high temperatures. It has two useful attributes: high thermal conductivity and low electrical conductivity. Filling the spiral Calrod range top heating elements on kitchen electric stoves is a major use. «By far the largest consumer of magnesia worldwide is the refractory industry, which consumed about 56% of the magnesia in the United States in 2004, the remaining 44% being used in agricultural, chemical, construction, environmental, and other industrial applications.» MgO is used as a basic refractory material for crucibles.[15]
Fireproofing[edit]
It is a principal fireproofing ingredient in construction materials. As a construction material, magnesium oxide wallboards have several attractive characteristics: fire resistance, termite resistance, moisture resistance, mold and mildew resistance, and strength.[16][15]
Gas mantles[edit]
Most gas mantles utilize magnesium oxide. Early iterations such as the Clamond basket used only this. Later versions use ~60% magnesium oxide, with other components such as lanthanum oxide or yttrium oxide making up the rest. Another exception would be thoriated gas mantles.
Niche uses[edit]
MgO is one of the components in Portland cement in dry process plants.
Magnesium oxide is used extensively in the soil and groundwater remediation, wastewater treatment, drinking water treatment, air emissions treatment, and waste treatment industries for its acid buffering capacity and related effectiveness in stabilizing dissolved heavy metal species.[according to whom?]
Many heavy metals species, such as lead and cadmium are most soluble in water at acidic pH (below 6) as well as high pH (above 11). Solubility of metals affects bioavailability of the species and mobility soil and groundwater systems. Most metal species are toxic to humans at certain concentrations, therefore it is imperative to minimize metal bioavailability and mobility.
Granular MgO is often blended into metals-contaminated soil or waste material, which is also commonly of a low pH (acidic), in order to drive the pH into the 8–10 range where most metals are at their lowest solubilities (basic). Metal-hydroxide complexes have a tendency to precipitate out of aqueous solution in the pH range of 8–10. MgO is widely regarded as the most effective metals stabilization compound when compared to Portland cement, lime, kiln dust products, power generation waste products, and various proprietary products due to MgO’s superior buffering capacity, cost effectiveness, and ease/safety of handling.
Most, if not all products that are marketed as metals stabilization technologies create very high pH conditions in aquifers whereas MgO creates an ideal aquifer condition with a pH of 8–10. Additionally, magnesium, an essential element to most biological systems, is provided to soil and groundwater microbial populations during MgO-assisted metals remediation as an added benefit.
Medical[edit]
Magnesium oxide is used for relief of heartburn and indigestion, as an antacid, magnesium supplement, and as a short-term laxative. It is also used to improve symptoms of indigestion. Side effects of magnesium oxide may include nausea and cramping.[17] In quantities sufficient to obtain a laxative effect, side effects of long-term use may rarely cause enteroliths to form, resulting in bowel obstruction.[18]
Other[edit]
- As a food additive, it is used as an anticaking agent. It is known to the US Food and Drug Administration for cacao products; canned peas; and frozen dessert.[19] It has an E number of E530.
- It was historically used as a reference white color in colorimetry, owing to its good diffusing and reflectivity properties.[20] It may be smoked onto the surface of an opaque material to form an integrating sphere.
- It is used extensively as an electrical insulator in tubular construction heating elements. There are several mesh sizes available and most commonly used ones are 40 and 80 mesh per the American Foundry Society. The extensive use is due to its high dielectric strength and average thermal conductivity. MgO is usually crushed and compacted with minimal airgaps or voids. The electrical heating industry also experimented with aluminium oxide, but it is not used anymore.
- As a reagent in the installation of the carboxybenzyl (Cbz) group using benzyl chloroformate in EtOAc for the N-protection of amines and amides.[21]
- It is also used as an insulator in heat-resistant electrical cable.
- MgO doping has been shown to effectively inhibit grain growth in ceramics and improve their fracture toughness by transforming[clarification needed] the mechanism of crack growth at nanoscale.[22]
- Pressed MgO is used as an optical material. It is transparent from 0.3 to 7 μm. The refractive index is 1.72 at 1 μm and the Abbe number is 53.58. It is sometimes known by the Eastman Kodak trademarked name Irtran-5, although this designation is obsolete. Crystalline pure MgO is available commercially and has a small use in infrared optics.[23]
- MgO is packed in bags around transuranic waste in the disposal cells (panels) at the Waste Isolation Pilot Plant, as a CO2 getter to minimize the complexation of uranium and other actinides by carbonate ions and so to limit the solubility of radionuclides. The use of MgO is preferred to this of CaO as the resulting hydration product (Mg(OH)
2) is less soluble and releases less hydration heat. Another advantage is to impose a lower pH value of ~ 10.5 in case of accidental water ingress in the dry salt layers while the more soluble Ca(OH)
2 would create a higher pH of 12.5 (strongly alkaline conditions). The Mg2+
cation being the second most abundant cation in seawater and in rocksalt, the potential release of magnesium ions dissolving in brines intruding the deep geological repository is also expected to minimize the geochemical perturbations.[24] - MgO has an important place as a commercial plant fertilizer[25] and as animal feed.[26]
- An aerosolized solution of MgO is used in library science and collections management for the deacidification of at-risk paper items. In this process, the alkalinity of MgO (and similar compounds) neutralizes the relatively high acidity characteristic of low-quality paper, thus slowing the rate of deterioration.[27]
- MgO is also used as a protective coating in plasma displays.
- Magnesium oxide is used as an oxide barrier in spin-tunneling devices. Owing to the crystalline structure of its thin films, which can be deposited by magnetron sputtering, for example, it shows characteristics superior to those of the commonly used amorphous Al2O3. In particular, spin polarization of about 85% has been achieved with MgO[28] versus 40–60 % with aluminium oxide.[29] The value of tunnel magnetoresistance is also significantly higher for MgO (600% at room temperature and 1,100 % at 4.2 K[30]) than Al2O3 (ca. 70% at room temperature[31]).
Precautions[edit]
Inhalation of magnesium oxide fumes can cause metal fume fever.[32]
See also[edit]
- Calcium oxide – Chemical compound of calcium
- Barium oxide – Chemical compound used in cathode ray tubes
- Calcium silicate – Chemical compound naturally occurring as the mineral larnite
- Magnesium sulfide – Inorganic compound generated in the production of metallic iron
- Reactive magnesia – chemical compound
Notes[edit]
- ^ At room temperature.[5][6][7]
References[edit]
- ^ a b c d Haynes, William M., ed. (2011). CRC Handbook of Chemistry and Physics (92nd ed.). Boca Raton, FL: CRC Press. p. 4.74. ISBN 1-4398-5511-0.
- ^ Taurian, O.E.; Springborg, M.; Christensen, N.E. (1985). «Self-consistent electronic structures of MgO and SrO» (PDF). Solid State Communications. 55 (4): 351–5. Bibcode:1985SSCom..55..351T. doi:10.1016/0038-1098(85)90622-2.
- ^ Haynes, William M., ed. (2011). CRC Handbook of Chemistry and Physics (92nd ed.). Boca Raton, FL: CRC Press. p. 4.133. ISBN 1-4398-5511-0.
- ^ Application of magnesium compounds to insulating heat-conductive fillers Archived 2013-12-30 at the Wayback Machine. konoshima.co.jp
- ^ a b A P, Johnson (November 1986). «Structural and electrical properties of magnesium oxide powders». Durham University.
{{cite web}}: CS1 maint: url-status (link) - ^ a b Subramanian, M. A.; Shannon, R. D.; Chai, B. H. T.; Abraham, M. M.; Wintersgill, M. C. (November 1989). «Dielectric constants of BeO, MgO, and CaO using the two-terminal method». Physics and Chemistry of Minerals. 16 (8): 741–746. doi:10.1007/BF00209695. ISSN 0342-1791. S2CID 95280958.
- ^ a b Hornak, Jaroslav; Trnka, Pavel; Kadlec, Petr; Michal, Ondřej; Mentlík, Václav; Šutta, Pavol; Csányi, Gergely; Tamus, Zoltán (2018-05-30). «Magnesium Oxide Nanoparticles: Dielectric Properties, Surface Functionalization and Improvement of Epoxy-Based Composites Insulating Properties». Nanomaterials. 8 (6): 381. doi:10.3390/nano8060381. ISSN 2079-4991. PMC 6027305. PMID 29848967.
- ^ a b Haynes, William M., ed. (2011). CRC Handbook of Chemistry and Physics (92nd ed.). Boca Raton, FL: CRC Press. p. 5.15. ISBN 1-4398-5511-0.
- ^ a b Haynes, William M., ed. (2011). CRC Handbook of Chemistry and Physics (92nd ed.). Boca Raton, FL: CRC Press. p. 5.2. ISBN 1-4398-5511-0.
- ^ a b c NIOSH Pocket Guide to Chemical Hazards. «#0374». National Institute for Occupational Safety and Health (NIOSH).
- ^ Zhu, Qiang; Oganov A.R.; Lyakhov A.O. (2013). «Novel stable compounds in the Mg-O system under high pressure» (PDF). Phys. Chem. Chem. Phys. 15 (20): 7696–7700. Bibcode:2013PCCP…15.7696Z. doi:10.1039/c3cp50678a. PMID 23595296.
- ^ Mei, AB; O. Hellman; C. M. Schlepütz; A. Rockett; T.-C. Chiang; L. Hultman; I. Petrov; J. E. Greene (2015). «Reflection Thermal Diffuse X-Ray Scattering for Quantitative Determination of Phonon Dispersion Relations». Physical Review B. 92 (17): 174301. Bibcode:2015PhRvB..92q4301M. doi:10.1103/physrevb.92.174301.
- ^ Margarete Seeger; Walter Otto; Wilhelm Flick; Friedrich Bickelhaupt; Otto S. Akkerman. «Magnesium Compounds». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a15_595.pub2.
- ^ Ropp, R C (2013-03-06). Encyclopedia of the alkaline earth compounds. Elsevier. p. 109. ISBN 9780444595508.
- ^ a b Mark A. Shand (2006). The chemistry and technology of magnesia. John Wiley and Sons. ISBN 978-0-471-65603-6. Retrieved 10 September 2011.
- ^ Mármol, Gonzalo; Savastano, Holmer (July 2017). «Study of the degradation of non-conventional MgO-SiO 2 cement reinforced with lignocellulosic fibers». Cement and Concrete Composites. 80: 258–267. doi:10.1016/j.cemconcomp.2017.03.015.
- ^ Magnesium Oxide. MedlinePlus. Last reviewed 02/01/2009
- ^ Tatekawa Y, Nakatani K, Ishii H, et al. (1996). «Small bowel obstruction caused by a medication bezoar: report of a case». Surgery Today. 26 (1): 68–70. doi:10.1007/BF00311997. PMID 8680127. S2CID 24976010.
- ^ «Compound Summary for CID 14792 – Magnesium Oxide». PubChem.
- ^ Tellex, Peter A.; Waldron, Jack R. (1955). «Reflectance of Magnesium Oxide». JOSA. 45 (1): 19. doi:10.1364/JOSA.45.000019.
- ^ Dymicky, M. (1989-02-01). «Preparation of Carbobenzoxy-L-Tyrosine Methyl and Ethyl Esters and of the Corresponding Carbobenzoxy Hydrazides». Organic Preparations and Procedures International. 21 (1): 83–90. doi:10.1080/00304948909356350. ISSN 0030-4948.
- ^ Tan, C.Y.; Yaghoubi, A.; Ramesh, S.; Adzila, S.; Purbolaksono, J.; Hassan, M.A.; Kutty, M.G. (December 2013). «Sintering and mechanical properties of MgO-doped nanocrystalline hydroxyapatite» (PDF). Ceramics International. 39 (8): 8979–8983. doi:10.1016/j.ceramint.2013.04.098.
- ^ Stephens, Robert E. & Malitson, Irving H. (1952). «Index of Refraction of Magnesium Oxide» (PDF). Journal of Research of the National Bureau of Standards. 49 (4): 249–252. doi:10.6028/jres.049.025.
- ^ wipp.energy.gov Step-By-Step Guide for Waste Handling at WIPP. Waste Isolation Pilot Plant. wipp.energy.gov
- ^ Nutrient Science. fertilizer101.org. Retrieved on 2017-04-26.
- ^ Magnesium oxide for the Animal Feed Industry. lehvoss.de
- ^ «Mass Deacidification: Saving the Written Word». Library of Congress. Retrieved 26 September 2011.
- ^ Parkin, S. S. P.; Kaiser, C.; Panchula, A.; Rice, P. M.; Hughes, B.; Samant, M.; Yang, S. H. (2004). «Giant tunnelling magnetoresistance at room temperature with MgO (100) tunnel barriers». Nature Materials. 3 (12): 862–867. Bibcode:2004NatMa…3..862P. doi:10.1038/nmat1256. PMID 15516928. S2CID 33709206.
- ^ Monsma, D. J.; Parkin, S. S. P. (2000). «Spin polarization of tunneling current from ferromagnet/Al2O3 interfaces using copper-doped aluminum superconducting films». Applied Physics Letters. 77 (5): 720. Bibcode:2000ApPhL..77..720M. doi:10.1063/1.127097.
- ^ Ikeda, S.; Hayakawa, J.; Ashizawa, Y.; Lee, Y. M.; Miura, K.; Hasegawa, H.; Tsunoda, M.; Matsukura, F.; Ohno, H. (2008). «Tunnel magnetoresistance of 604% at 300 K by suppression of Ta diffusion in CoFeB/MgO/CoFeB pseudo-spin-valves annealed at high temperature». Applied Physics Letters. 93 (8): 082508. Bibcode:2008ApPhL..93h2508I. doi:10.1063/1.2976435. S2CID 122271110.
- ^ Wang, D.; Nordman, C.; Daughton, J. M.; Qian, Z.; Fink, J.; Wang, D.; Nordman, C.; Daughton, J. M.; Qian, Z.; Fink, J. (2004). «70% TMR at Room Temperature for SDT Sandwich Junctions with CoFeB as Free and Reference Layers». IEEE Transactions on Magnetics. 40 (4): 2269. Bibcode:2004ITM….40.2269W. CiteSeerX 10.1.1.476.8544. doi:10.1109/TMAG.2004.830219. S2CID 20439632.
- ^ Magnesium Oxide. National Pollutant Inventory, Government of Australia.
External links[edit]
- Data page at UCL
- Ceramic data page at NIST
- NIOSH Pocket Guide to Chemical Hazards at CDC
From Wikipedia, the free encyclopedia

|
|

|
|
| Names | |
|---|---|
| IUPAC name
Magnesium oxide |
|
| Other names
Magnesia |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChEMBL |
|
| ChemSpider |
|
| ECHA InfoCard | 100.013.793 |
| EC Number |
|
| E number | E530 (acidity regulators, …) |
| KEGG |
|
|
PubChem CID |
|
| RTECS number |
|
| UNII |
|
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
MgO |
| Molar mass | 40.304 g/mol[1] |
| Appearance | White powder |
| Odor | Odorless |
| Density | 3.6 g/cm3[1] |
| Melting point | 2,852 °C (5,166 °F; 3,125 K)[1] |
| Boiling point | 3,600 °C (6,510 °F; 3,870 K)[1] |
| Solubility | Soluble in acid, ammonia insoluble in alcohol |
| Electrical resistivity | Dielectric[a] |
| Band gap | 7.8 eV[2] |
|
Magnetic susceptibility (χ) |
−10.2·10−6 cm3/mol[3] |
| Thermal conductivity | 45–60 W·m−1·K−1[4] |
|
Refractive index (nD) |
1.7355 |
|
Dipole moment |
6.2 ± 0.6 D |
| Structure | |
|
Crystal structure |
Halite (cubic), cF8 |
|
Space group |
Fm3m, No. 225 |
|
Lattice constant |
a = 4.212Å |
|
Coordination geometry |
Octahedral (Mg2+); octahedral (O2−) |
| Thermochemistry | |
|
Heat capacity (C) |
37.2 J/mol K[8] |
|
Std molar |
26.95 ± 0.15 J·mol−1·K−1[9] |
|
Std enthalpy of |
−601.6 ± 0.3 kJ·mol−1[9] |
|
Gibbs free energy (ΔfG⦵) |
-569.3 kJ/mol[8] |
| Pharmacology | |
|
ATC code |
A02AA02 (WHO) A06AD02 (WHO), A12CC10 (WHO) |
| Hazards | |
| Occupational safety and health (OHS/OSH): | |
|
Main hazards |
Metal fume fever, Irritant |
| GHS labelling: | |
|
Pictograms |

|
|
Signal word |
Warning |
|
Hazard statements |
H315, H319, H335 |
|
Precautionary statements |
P261, P264, P271, P273, P280, P302+P352, P304+P340, P305+P351+P338, P312, P333+P313, P337+P313, P362, P363, P391, P403+P233, P405 |
| NFPA 704 (fire diamond) |
1 0 0 |
| Flash point | Non-flammable |
| NIOSH (US health exposure limits): | |
|
PEL (Permissible) |
TWA 15 mg/m3 (fume)[10] |
|
REL (Recommended) |
None designated[10] |
|
IDLH (Immediate danger) |
750 mg/m3 (fume)[10] |
| Safety data sheet (SDS) | ICSC 0504 |
| Related compounds | |
|
Other anions |
Magnesium sulfide |
|
Other cations |
Beryllium oxide Calcium oxide Strontium oxide Barium oxide |
|
Related compounds |
Magnesium hydroxide Magnesium nitride |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Magnesium oxide (MgO), or magnesia, is a white hygroscopic solid mineral that occurs naturally as periclase and is a source of magnesium (see also oxide). It has an empirical formula of MgO and consists of a lattice of Mg2+ ions and O2− ions held together by ionic bonding. Magnesium hydroxide forms in the presence of water (MgO + H2O → Mg(OH)2), but it can be reversed by heating it to remove moisture.
Magnesium oxide was historically known as magnesia alba (literally, the white mineral from Magnesia), to differentiate it from magnesia negra, a black mineral containing what is now known as manganese.
[edit]
While «magnesium oxide» normally refers to MgO, the compound magnesium peroxide MgO2 is also known. According to evolutionary crystal structure prediction,[11] MgO2 is thermodynamically stable at pressures above 116 GPa (gigapascals), and a semiconducting suboxide Mg3O2 is thermodynamically stable above 500 GPa. Because of its stability, MgO is used as a model system for investigating vibrational properties of crystals.[12]
Electric properties[edit]
Pure MgO is not conductive and has a high resistance to electric current at room temperature. The pure powder of MgO has a relative permittivity inbetween 3.2 to 9.9 
Production[edit]
Magnesium oxide is produced by the calcination of magnesium carbonate or magnesium hydroxide. The latter is obtained by the treatment of magnesium chloride MgCl
2 solutions, typically seawater, with limewater or milk of lime.[13]
- Mg2+ + Ca(OH)2 → Mg(OH)2 + Ca2+
Calcining at different temperatures produces magnesium oxide of different reactivity. High temperatures 1500 – 2000 °C diminish the available surface area and produces dead-burned (often called dead burnt) magnesia, an unreactive form used as a refractory. Calcining temperatures 1000 – 1500 °C produce hard-burned magnesia, which has limited reactivity and calcining at lower temperature, (700–1000 °C) produces light-burned magnesia, a reactive form, also known as caustic calcined magnesia. Although some decomposition of the carbonate to oxide occurs at temperatures below 700 °C, the resulting materials appear to reabsorb carbon dioxide from the air.[14]
Applications[edit]
Heating elements[edit]
MgO is prized as a refractory material, i.e. a solid that is physically and chemically stable at high temperatures. It has two useful attributes: high thermal conductivity and low electrical conductivity. Filling the spiral Calrod range top heating elements on kitchen electric stoves is a major use. «By far the largest consumer of magnesia worldwide is the refractory industry, which consumed about 56% of the magnesia in the United States in 2004, the remaining 44% being used in agricultural, chemical, construction, environmental, and other industrial applications.» MgO is used as a basic refractory material for crucibles.[15]
Fireproofing[edit]
It is a principal fireproofing ingredient in construction materials. As a construction material, magnesium oxide wallboards have several attractive characteristics: fire resistance, termite resistance, moisture resistance, mold and mildew resistance, and strength.[16][15]
Gas mantles[edit]
Most gas mantles utilize magnesium oxide. Early iterations such as the Clamond basket used only this. Later versions use ~60% magnesium oxide, with other components such as lanthanum oxide or yttrium oxide making up the rest. Another exception would be thoriated gas mantles.
Niche uses[edit]
MgO is one of the components in Portland cement in dry process plants.
Magnesium oxide is used extensively in the soil and groundwater remediation, wastewater treatment, drinking water treatment, air emissions treatment, and waste treatment industries for its acid buffering capacity and related effectiveness in stabilizing dissolved heavy metal species.[according to whom?]
Many heavy metals species, such as lead and cadmium are most soluble in water at acidic pH (below 6) as well as high pH (above 11). Solubility of metals affects bioavailability of the species and mobility soil and groundwater systems. Most metal species are toxic to humans at certain concentrations, therefore it is imperative to minimize metal bioavailability and mobility.
Granular MgO is often blended into metals-contaminated soil or waste material, which is also commonly of a low pH (acidic), in order to drive the pH into the 8–10 range where most metals are at their lowest solubilities (basic). Metal-hydroxide complexes have a tendency to precipitate out of aqueous solution in the pH range of 8–10. MgO is widely regarded as the most effective metals stabilization compound when compared to Portland cement, lime, kiln dust products, power generation waste products, and various proprietary products due to MgO’s superior buffering capacity, cost effectiveness, and ease/safety of handling.
Most, if not all products that are marketed as metals stabilization technologies create very high pH conditions in aquifers whereas MgO creates an ideal aquifer condition with a pH of 8–10. Additionally, magnesium, an essential element to most biological systems, is provided to soil and groundwater microbial populations during MgO-assisted metals remediation as an added benefit.
Medical[edit]
Magnesium oxide is used for relief of heartburn and indigestion, as an antacid, magnesium supplement, and as a short-term laxative. It is also used to improve symptoms of indigestion. Side effects of magnesium oxide may include nausea and cramping.[17] In quantities sufficient to obtain a laxative effect, side effects of long-term use may rarely cause enteroliths to form, resulting in bowel obstruction.[18]
Other[edit]
- As a food additive, it is used as an anticaking agent. It is known to the US Food and Drug Administration for cacao products; canned peas; and frozen dessert.[19] It has an E number of E530.
- It was historically used as a reference white color in colorimetry, owing to its good diffusing and reflectivity properties.[20] It may be smoked onto the surface of an opaque material to form an integrating sphere.
- It is used extensively as an electrical insulator in tubular construction heating elements. There are several mesh sizes available and most commonly used ones are 40 and 80 mesh per the American Foundry Society. The extensive use is due to its high dielectric strength and average thermal conductivity. MgO is usually crushed and compacted with minimal airgaps or voids. The electrical heating industry also experimented with aluminium oxide, but it is not used anymore.
- As a reagent in the installation of the carboxybenzyl (Cbz) group using benzyl chloroformate in EtOAc for the N-protection of amines and amides.[21]
- It is also used as an insulator in heat-resistant electrical cable.
- MgO doping has been shown to effectively inhibit grain growth in ceramics and improve their fracture toughness by transforming[clarification needed] the mechanism of crack growth at nanoscale.[22]
- Pressed MgO is used as an optical material. It is transparent from 0.3 to 7 μm. The refractive index is 1.72 at 1 μm and the Abbe number is 53.58. It is sometimes known by the Eastman Kodak trademarked name Irtran-5, although this designation is obsolete. Crystalline pure MgO is available commercially and has a small use in infrared optics.[23]
- MgO is packed in bags around transuranic waste in the disposal cells (panels) at the Waste Isolation Pilot Plant, as a CO2 getter to minimize the complexation of uranium and other actinides by carbonate ions and so to limit the solubility of radionuclides. The use of MgO is preferred to this of CaO as the resulting hydration product (Mg(OH)
2) is less soluble and releases less hydration heat. Another advantage is to impose a lower pH value of ~ 10.5 in case of accidental water ingress in the dry salt layers while the more soluble Ca(OH)
2 would create a higher pH of 12.5 (strongly alkaline conditions). The Mg2+
cation being the second most abundant cation in seawater and in rocksalt, the potential release of magnesium ions dissolving in brines intruding the deep geological repository is also expected to minimize the geochemical perturbations.[24] - MgO has an important place as a commercial plant fertilizer[25] and as animal feed.[26]
- An aerosolized solution of MgO is used in library science and collections management for the deacidification of at-risk paper items. In this process, the alkalinity of MgO (and similar compounds) neutralizes the relatively high acidity characteristic of low-quality paper, thus slowing the rate of deterioration.[27]
- MgO is also used as a protective coating in plasma displays.
- Magnesium oxide is used as an oxide barrier in spin-tunneling devices. Owing to the crystalline structure of its thin films, which can be deposited by magnetron sputtering, for example, it shows characteristics superior to those of the commonly used amorphous Al2O3. In particular, spin polarization of about 85% has been achieved with MgO[28] versus 40–60 % with aluminium oxide.[29] The value of tunnel magnetoresistance is also significantly higher for MgO (600% at room temperature and 1,100 % at 4.2 K[30]) than Al2O3 (ca. 70% at room temperature[31]).
Precautions[edit]
Inhalation of magnesium oxide fumes can cause metal fume fever.[32]
See also[edit]
- Calcium oxide – Chemical compound of calcium
- Barium oxide – Chemical compound used in cathode ray tubes
- Calcium silicate – Chemical compound naturally occurring as the mineral larnite
- Magnesium sulfide – Inorganic compound generated in the production of metallic iron
- Reactive magnesia – chemical compound
Notes[edit]
- ^ At room temperature.[5][6][7]
References[edit]
- ^ a b c d Haynes, William M., ed. (2011). CRC Handbook of Chemistry and Physics (92nd ed.). Boca Raton, FL: CRC Press. p. 4.74. ISBN 1-4398-5511-0.
- ^ Taurian, O.E.; Springborg, M.; Christensen, N.E. (1985). «Self-consistent electronic structures of MgO and SrO» (PDF). Solid State Communications. 55 (4): 351–5. Bibcode:1985SSCom..55..351T. doi:10.1016/0038-1098(85)90622-2.
- ^ Haynes, William M., ed. (2011). CRC Handbook of Chemistry and Physics (92nd ed.). Boca Raton, FL: CRC Press. p. 4.133. ISBN 1-4398-5511-0.
- ^ Application of magnesium compounds to insulating heat-conductive fillers Archived 2013-12-30 at the Wayback Machine. konoshima.co.jp
- ^ a b A P, Johnson (November 1986). «Structural and electrical properties of magnesium oxide powders». Durham University.
{{cite web}}: CS1 maint: url-status (link) - ^ a b Subramanian, M. A.; Shannon, R. D.; Chai, B. H. T.; Abraham, M. M.; Wintersgill, M. C. (November 1989). «Dielectric constants of BeO, MgO, and CaO using the two-terminal method». Physics and Chemistry of Minerals. 16 (8): 741–746. doi:10.1007/BF00209695. ISSN 0342-1791. S2CID 95280958.
- ^ a b Hornak, Jaroslav; Trnka, Pavel; Kadlec, Petr; Michal, Ondřej; Mentlík, Václav; Šutta, Pavol; Csányi, Gergely; Tamus, Zoltán (2018-05-30). «Magnesium Oxide Nanoparticles: Dielectric Properties, Surface Functionalization and Improvement of Epoxy-Based Composites Insulating Properties». Nanomaterials. 8 (6): 381. doi:10.3390/nano8060381. ISSN 2079-4991. PMC 6027305. PMID 29848967.
- ^ a b Haynes, William M., ed. (2011). CRC Handbook of Chemistry and Physics (92nd ed.). Boca Raton, FL: CRC Press. p. 5.15. ISBN 1-4398-5511-0.
- ^ a b Haynes, William M., ed. (2011). CRC Handbook of Chemistry and Physics (92nd ed.). Boca Raton, FL: CRC Press. p. 5.2. ISBN 1-4398-5511-0.
- ^ a b c NIOSH Pocket Guide to Chemical Hazards. «#0374». National Institute for Occupational Safety and Health (NIOSH).
- ^ Zhu, Qiang; Oganov A.R.; Lyakhov A.O. (2013). «Novel stable compounds in the Mg-O system under high pressure» (PDF). Phys. Chem. Chem. Phys. 15 (20): 7696–7700. Bibcode:2013PCCP…15.7696Z. doi:10.1039/c3cp50678a. PMID 23595296.
- ^ Mei, AB; O. Hellman; C. M. Schlepütz; A. Rockett; T.-C. Chiang; L. Hultman; I. Petrov; J. E. Greene (2015). «Reflection Thermal Diffuse X-Ray Scattering for Quantitative Determination of Phonon Dispersion Relations». Physical Review B. 92 (17): 174301. Bibcode:2015PhRvB..92q4301M. doi:10.1103/physrevb.92.174301.
- ^ Margarete Seeger; Walter Otto; Wilhelm Flick; Friedrich Bickelhaupt; Otto S. Akkerman. «Magnesium Compounds». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a15_595.pub2.
- ^ Ropp, R C (2013-03-06). Encyclopedia of the alkaline earth compounds. Elsevier. p. 109. ISBN 9780444595508.
- ^ a b Mark A. Shand (2006). The chemistry and technology of magnesia. John Wiley and Sons. ISBN 978-0-471-65603-6. Retrieved 10 September 2011.
- ^ Mármol, Gonzalo; Savastano, Holmer (July 2017). «Study of the degradation of non-conventional MgO-SiO 2 cement reinforced with lignocellulosic fibers». Cement and Concrete Composites. 80: 258–267. doi:10.1016/j.cemconcomp.2017.03.015.
- ^ Magnesium Oxide. MedlinePlus. Last reviewed 02/01/2009
- ^ Tatekawa Y, Nakatani K, Ishii H, et al. (1996). «Small bowel obstruction caused by a medication bezoar: report of a case». Surgery Today. 26 (1): 68–70. doi:10.1007/BF00311997. PMID 8680127. S2CID 24976010.
- ^ «Compound Summary for CID 14792 – Magnesium Oxide». PubChem.
- ^ Tellex, Peter A.; Waldron, Jack R. (1955). «Reflectance of Magnesium Oxide». JOSA. 45 (1): 19. doi:10.1364/JOSA.45.000019.
- ^ Dymicky, M. (1989-02-01). «Preparation of Carbobenzoxy-L-Tyrosine Methyl and Ethyl Esters and of the Corresponding Carbobenzoxy Hydrazides». Organic Preparations and Procedures International. 21 (1): 83–90. doi:10.1080/00304948909356350. ISSN 0030-4948.
- ^ Tan, C.Y.; Yaghoubi, A.; Ramesh, S.; Adzila, S.; Purbolaksono, J.; Hassan, M.A.; Kutty, M.G. (December 2013). «Sintering and mechanical properties of MgO-doped nanocrystalline hydroxyapatite» (PDF). Ceramics International. 39 (8): 8979–8983. doi:10.1016/j.ceramint.2013.04.098.
- ^ Stephens, Robert E. & Malitson, Irving H. (1952). «Index of Refraction of Magnesium Oxide» (PDF). Journal of Research of the National Bureau of Standards. 49 (4): 249–252. doi:10.6028/jres.049.025.
- ^ wipp.energy.gov Step-By-Step Guide for Waste Handling at WIPP. Waste Isolation Pilot Plant. wipp.energy.gov
- ^ Nutrient Science. fertilizer101.org. Retrieved on 2017-04-26.
- ^ Magnesium oxide for the Animal Feed Industry. lehvoss.de
- ^ «Mass Deacidification: Saving the Written Word». Library of Congress. Retrieved 26 September 2011.
- ^ Parkin, S. S. P.; Kaiser, C.; Panchula, A.; Rice, P. M.; Hughes, B.; Samant, M.; Yang, S. H. (2004). «Giant tunnelling magnetoresistance at room temperature with MgO (100) tunnel barriers». Nature Materials. 3 (12): 862–867. Bibcode:2004NatMa…3..862P. doi:10.1038/nmat1256. PMID 15516928. S2CID 33709206.
- ^ Monsma, D. J.; Parkin, S. S. P. (2000). «Spin polarization of tunneling current from ferromagnet/Al2O3 interfaces using copper-doped aluminum superconducting films». Applied Physics Letters. 77 (5): 720. Bibcode:2000ApPhL..77..720M. doi:10.1063/1.127097.
- ^ Ikeda, S.; Hayakawa, J.; Ashizawa, Y.; Lee, Y. M.; Miura, K.; Hasegawa, H.; Tsunoda, M.; Matsukura, F.; Ohno, H. (2008). «Tunnel magnetoresistance of 604% at 300 K by suppression of Ta diffusion in CoFeB/MgO/CoFeB pseudo-spin-valves annealed at high temperature». Applied Physics Letters. 93 (8): 082508. Bibcode:2008ApPhL..93h2508I. doi:10.1063/1.2976435. S2CID 122271110.
- ^ Wang, D.; Nordman, C.; Daughton, J. M.; Qian, Z.; Fink, J.; Wang, D.; Nordman, C.; Daughton, J. M.; Qian, Z.; Fink, J. (2004). «70% TMR at Room Temperature for SDT Sandwich Junctions with CoFeB as Free and Reference Layers». IEEE Transactions on Magnetics. 40 (4): 2269. Bibcode:2004ITM….40.2269W. CiteSeerX 10.1.1.476.8544. doi:10.1109/TMAG.2004.830219. S2CID 20439632.
- ^ Magnesium Oxide. National Pollutant Inventory, Government of Australia.
External links[edit]
- Data page at UCL
- Ceramic data page at NIST
- NIOSH Pocket Guide to Chemical Hazards at CDC
Химическое название
Оксид магния
Химические свойства
Вещество имеет ряд традиционных названий: жженая магнезия, периклаз. Химическая формула оксида магния: MgO. Согласно фармакопее, соединение представляет собой мелкие белые кристаллы, которые не растворяются в воде. В фармакологии средство используют в форме легкого, белого рыхлого порошка, который обладает способностью впитывать воду. Оксид кипит при 3600 градусах Цельсия, молекулярная масса = 40,3 грамма на моль.
Химические свойства Оксида Магния. Вещество вступает в реакции с разбавленными к-ами, при этом образуя соли. Оксид Магния реагирует с горячей водой с образованием гидроксида, не вступает в реакцию с холодной жидкостью. Magnesii oxydum (Оксид Магния на латинском) получают при обжиге магнезита и доломита. MgCO3 разлагается до оксида и угарного газа.
Применение вещества:
- используют в промышленности при производстве огнеупорных материалов, цемента, для очистки от примесей нефтепродуктов, в качестве наполнителя при производстве резиновых изделий;
- в качестве абразива для очистки различных поверхностей в промышленности;
- в пищевой промышленности в качестве добавки E530;
- спортсмены используют жженую магнезию в качестве присыпки, чтобы не соскальзывать со снарядов;
- в медицине – для нейтрализации соляной или других кислот в желудке.
Фармакологическое действие
Противоязвенное, стимулирующее перистальтику кишечника, противовоспалительное, антацидное.
Фармакодинамика и фармакокинетика
Магния Оксид после попадания в пищеварительный тракт под действием воды превращается в гидроксид. Вещество нейтрализует соляную кислоту, снижает активность пищеварительных ферментов в целом. После приема лекарства на голодных желудок антацидный эффект сохраняется на протяжении получаса. При приеме после еды – до 4 часов.
В желудке также образуется магния хлорид, который, при проникновении в кишечник, увеличивает осмотическое давление, оказывает слабительное действие, усиливая перистальтику кишечника.
Вещество не всасывается через стенки желудка и не проникает в системный кровоток. Вторичной гиперсекреции при лечении средством не наблюдается. Лекарство не вызывает алкалоз.
При сочетании средства с пиридоксином снижается интенсивность образования оксалата кальция. Такая комбинация лек. препаратов предупреждает образование оксалатных камней.
Показания к применению
Лекарство назначают:
- при остром гастрите, при обострении хронического гастрита с повышенной или нормальной секрецией желудочных кислот;
- пациентам с обострением язвы желудка и 12-перстной кишки;
- больным с гастралгией, диспепсией после приема лекарств, нарушения диеты, употребления алкоголя, кофе или никотина;
- при рефлюкс-эзофагите;
- пациентам с панкреатитом;
- для лечения запоров;
- после отравления кислотами;
- в комбинации с прочими лекарствами для профилактики оксалатного нефроуролитиаза.
Противопоказания
Вещество не используют:
- при гипермагниемии;
- при повышенной чувствительности.
Не все лекарственные формы можно применять в педиатрической практике.
Побочные действия
Магния Оксид может спровоцировать диарею, диспепсию, аллергические реакции.
Инструкция по применению (Способ и дозировка)
Лекарство назначают внутрь. В среднем разовая дозировка составляет 250 мг – 2,5 грамма. Кратность применения зависит от показаний.
Передозировка
Данные о передозировке отсутствуют.
Взаимодействие
Магния Оксид уменьшает побочные реакции от приема антацидных средств с алюминием, увеличивает продолжительность их действия.
При сочетании препарата с индометацином снижается плазменная концентрация последнего, уменьшается раздражающее действие лекарства на пищеварительный тракт.
Лекарство снижает скорость всасывания нитрофурантоина, солей железа и тетрациклина.
Вещество замедляет всасывание азитромицина, снижает его максимальную концентрацию в крови и время достижения этой концентрации. Такая комбинация не рекомендуется.
Особые указания
Особую осторожность рекомендуется соблюдать пациентам с заболеваниями почек. При длительном лечении может возникнуть гипермагниемия.
Лекарство часто пьют совместно с антацидами алюминия, чтобы снизить побочные эффекты со стороны пищеварительной системы и увеличить продолжительность действия препарата.
Детям
Средство редко применяют в педиатрической практике. Не все лекарственные формы можно использовать у детей.
При беременности и лактации
Можно назначать во время кормления грудью и при беременности.
Препараты, в которых содержится (Аналоги)
Торговое название вещества: Окись Магния.
Отзывы
Отзывов об использовании лекарства практически нет. Некоторые отмечают, что его сложно приобрести в аптеке. Отрицательных отзывов о применении средства не обнаружено.
Цена, где купить
Купить Оксид Магния, дозировкой 400 мг – таблетки, можно приблизительно за 600 рублей, 60 штук.
Химия — Оксид магния
01 марта 2011
Оксид магния химическое соединение с формулой MgO, бесцветные кристаллы, нерастворимые в воде, пожаро- и взрывобезопасен.
Основная форма минерал периклаз.
Физические свойства
Легкий, рыхлый порошок белого цвета, легко впитывает воду. На этом свойстве основано его применение в спортивной гимнастике, нанесенный на ладони спортсмена, порошок предохраняет его от опасности сорваться с гимнастического снаряда. Температура плавления 2825 °C.температура кипения — 3600 °C.Плотность=3,58 г/см3.
Химические свойства
Легко реагирует с разбавленными кислотами и водой с образованием солей и Mg2:
- MgO + 2HCl → MgCl2 + H2O;
- MgO + H2O → Mg2.
Применение
В промышленности применяется для производства огнеупоров, цементов, очистки нефтепродуктов, как наполнитель при производстве резины. Сверхлегкая окись магния применяется как очень мелкий абразив для очистки поверхностей, в частности, в электронной промышленности.
В медицине применяют при повышенной кислотности желудочного сока, так как она обусловливается избыточным содержанием соляной кислоты. Жжёную магнезию принимают также при случайном попадании в желудок кислот.
В пищевой промышленности зарегистрирован в качестве пищевой добавки E530.
Является абсолютным отражателем веществом с коэффициентом отражения, равным единице в широкой спектральной полосе. Может применяться как доступный эталон белого цвета.
Просмотров: 2083
Окси́д ма́гния (жжёная магнезия) — химическое соединение с формулой MgO, белые кристаллы, малорастворимые в воде, пожаро- и взрывобезопасен. Относится к классу основных оксидов. Основная форма — минерал периклаз.
Физические свойства[править | править код]
Легкий, рыхлый порошок белого цвета, легко впитывает воду. На этом свойстве основано его применение в спортивной гимнастике: нанесенный на ладони спортсмена, порошок предохраняет его от опасности сорваться с гимнастического снаряда.
Температура плавления — 2825 °C. Температура кипения — 3600 °C. Плотность=3,58 г/см3.
Химические свойства[править | править код]
Реагирует с разбавленными кислотами с образованием солей, плохо — с холодной водой, образуя Mg(OH)2:
С горячей водой реагирует лучше, реакция идет быстрее.
Получение[править | править код]
Оксид магния получают обжигом минералов магнезита и доломита, а также брусита.
Применение[править | править код]
В промышленности применяется для производства огнеупоров, цементов, очистки нефтепродуктов, как наполнитель при производстве резины, наполнитель в ТЭНах. Сверхлегкий оксид магния применяется как очень мелкий абразив для очистки поверхностей, в частности, в электронной промышленности.
В медицине применяют при повышенной кислотности желудочного сока, так как она обусловливается избыточным содержанием соляной кислоты. Жжёную магнезию принимают также при случайном попадании в желудок кислот.
В пищевой промышленности зарегистрирован в качестве пищевой добавки E530.
Является абсолютным отражателем — веществом с коэффициентом отражения, равным единице в широкой спектральной полосе. Может применяться как доступный эталон белого цвета.
См. также[править | править код]
- Стекломагниевый лист
Примечания[править | править код]
Литература[править | править код]
- Кнунянц И. Л. и др. т.2 Даффа-Меди // Химическая энциклопедия. — М.: Советская энциклопедия, 1990. — 671 с. — 100 000 экз. — ISBN 5-85270-035-5.
Физические свойства
Оксид магния MgO — бинарное неорганическое вещество. Белый, тугоплавкий, термически устойчивый, не реагирует с водой. Проявляет основные свойства.
Относительная молекулярная масса Mr = 40,3; относительная плотность для тв. и ж. состояния d = 3,62; tпл ≈ 2825º C; tкип = 3600º C.
Способ получения
1. Оксид магния получается при разложении карбоната магния при температуре 350 — 650º C. В результате разложения образуется оксид магния и углекислый газ:
MgCO3 = MgO + CO2
2. В результате разложения нитрата магния при температуре выше 300º С образуется оксид магния, оксид азота (IV) и кислород:
2Mg(NO3)2 = 2MgO + 4NO2 + O2
3. Гидроксид магния разлагается при 350-480º С с образованием оксида магния и воды:
Mg(OH)2 = MgO + H2O
4. Оксид магния можно получить путем разложения сульфата магния при температуре выше 1200º C, образуется оксид магния, кислород и оксид серы (IV):
2MgSO4 = 2MgO + 2SO2 + O2
5. Оксид магния можно получить сжиганием магния в в кислороде при 600 — 650º С:
2Mg + O2 = 2MgO
Химические свойства
1. Оксид магния реагирует с простыми веществами:
1.1. В результате реакции между оксидом магния и кальцием при температуре выше 400º С образуется магний и оксид кальция:
MgO + Ca = CaO + Mg
1.2. Оксид магния реагирует с углеродом при температуре выше 2000º С и образует магний и угарный газ:
MgO + C = Mg + CO
2. Оксид магния взаимодействует со сложными веществами:
2.1. Оксид магния взаимодействует с кислотами. При этом образуются соль и вода.
2.1.1. Оксид магния с разбавленной соляной кислотой образует хлорид магния и воду:
MgO + 2HCl = MgCl2 + H2O
2.3. Оксид магния взаимодействует с водой при 100 — 125º С, образуя гидроксид магния:
MgO + H2O = Mg(OH)2
МАГНИЯ ОКСИД
- МАГНИЯ ОКСИД
-
(жженая магнезия) MgO, бесцв. кристаллы с кубич. решеткой (а= 0,4213 нм, z = 4, пространств. группа Fm3m); т. пл. 2827 °С, т. кип. 3600 °С; плотн. 3,58 г/см 3 (25°С); С 0 р 37,24 Дж/(моль. К); DH0 обр -601,50 кДж/моль, DH0 пл 77 кДж/моль; S0298 26,95 Дж/(моль. К). В природе минерал периклаз. Св-ва М. о. (реакц. способность, адсорбц. св-ва, теплопроводность, плотность и др.) зависят от т-ры его получения. М. о., приготовленный при 500-700°С, т. наз. легкая магнезия, — бесцв. порошок; легко реагирует с разб. к-тами и водой с образованием соотв. солей и Mg(OH)2; с метанолом дает (CH3O)2Mg. С р-рами солей Mg образует основные соли (напр., основные хлориды, входящие в состав магнезиальных цементов), с р-рами солей трехвалентных металлов — двойные основные соли. Поглощает СО 2 и влагу из воздуха, давая основной карбонат Mg (см. Магния карбонат). С повышением т-ры получения М. о. его реакц. способность снижается. М. о., приготовленный при 1200-1600°С, т. наз. тяжелая магнезия, или металлургич. порошок, состоит из крупных кристаллов периклаза и характеризуется кислотостойкостью и водостойкостью. М. о. при сплавлении с Аl2 О 3, Fe2O3, Сr2 О 3 и др. оксидами М 2 О 3 образует шпинели MgM2IIIO4. Восстанавливается при высокой т-ре до металла калием, Са, Si, CaC2. М. о. получают обжигом магнезита MgCO3, доломита MgCO3.CaCO3, основного карбоната Mg, прокаливанием MgCl2.6H2O (бишофита) в атмосфере водяного пара, а также прокаливанием Mg(OH)2 и др. термически нестойких соед. Mg. Легкие сорта магнезии [к ним относят также Mg(OH)2 и основной карбонат] применяют для очистки нефтепродуктов, в медицине в качестве ср-ва для понижения кислотности желудка и легкого слабительного. Менее легкие сорта магнезии, напр. каустич. магнезит, полученный прокаливанием магнезита при 700-900 °С, используют для приготовления магнезиального цемента и строит. материалов на его основе (ксилолита, фибролита и др.), в качестве вулканизирующего агента в резиновой пром-сти; тяжелые сорта магнезии — в произ-ве огнеупоров. Лит.: Позин М. Е., Технология минеральных солей, 4 изд., ч. 1, Л., 1974, с. 263-310; Рипан Р., Четяну И., Неорганическая химия, пер. с рум., т. 1, М., 1971, с. 175-76. В. П. Данилов.
Химическая энциклопедия. — М.: Советская энциклопедия.
.
1988.
Полезное
Смотреть что такое «МАГНИЯ ОКСИД» в других словарях:
-
МАГНИЯ ОКСИД — (жженая магнезия) MgO, бесцветные кристаллы, tпл ок. 2825 .С. Получают обжигом минералов магнезита и доломита. Применяется для производства огнеупоров, цементов, очистки нефтепродуктов; как наполнитель при производстве резины; в медицине … Большой Энциклопедический словарь
-
магния оксид — (жжёная магнезия), MgO, бесцветные кристаллы, tпл около 2825°C. Получают обжигом минералов магнезита и доломита. Применяется для производства огнеупоров, цементов, очистки нефтепродуктов; как наполнитель при производстве резины; в медицине. * * * … Энциклопедический словарь
-
магния оксид — magnio oksidas statusas T sritis chemija formulė MgO atitikmenys: angl. magnesia; magnesium oxide rus. магнезия; магния оксид ryšiai: sinonimas – magnezija … Chemijos terminų aiškinamasis žodynas
-
МАГНИЯ ОКСИД — (жжёная магнезия), MgO, бесцв. кристаллы, tnл ок. 2825 0С. Получают обжигом минералов магнезита и доломита. Применяется для произ ва огнеупоров, цементов, очистки нефтепродуктов; как наполнитель при произ ве резины; в медицине … Естествознание. Энциклопедический словарь
-
Оксид магния — Оксид магния … Википедия
-
Оксид магния(II) — Оксид магния Оксид магния (жжёная магнезия, периклаз), MgO бесцветные кристаллы, нерастворимые в воде, пожаро и взрывобезопасен. Основная форма минерал периклаз. Содержание 1 Свойства 2 … Википедия
-
Оксид магния (II) — Оксид магния Оксид магния (жжёная магнезия, периклаз), MgO бесцветные кристаллы, нерастворимые в воде, пожаро и взрывобезопасен. Основная форма минерал периклаз. Содержание 1 Свойства 2 … Википедия
-
Магния окись — Оксид магния Оксид магния (жжёная магнезия, периклаз), MgO бесцветные кристаллы, нерастворимые в воде, пожаро и взрывобезопасен. Основная форма минерал периклаз. Содержание 1 Свойства 2 … Википедия
-
Магния карбонат основной — Магния карбонат (Magnesii carbonas) Химическое соединение ИЮПАК Карбонат магния Брутто формула MgCO … Википедия
-
МАГНИЯ ГИДРОКСИД — Mg(OH)2, бесцв. кристаллы с гексагон. решеткой (а= 0,3147 нм, с =0,4769 нм, z = 1, пространств. группа Р3m1); плотн. 2,36 г/см 3; С 0 р 77,11 Дж/(моль. К); DH0 обр 924,35 кДж/моль; S0298 63,18 Дж/(моль. К). Выше 350 °С разлагается на MgO и… … Химическая энциклопедия
| Оксид магния | |
|---|---|
 |
|
 |
|
| Общие | |
| Систематическое наименование |
Оксид магния |
| Традиционные названия | Жжёная магнезия, периклаз |
| Хим. формула | MgO |
| Физические свойства | |
| Состояние | твёрдое |
| Молярная масса | 40,3044 г/моль |
| Плотность | 3,58 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 2825 °C |
| • кипения | 3600 °C |
| Энтальпия | |
| • образования | -601,8 кДж/моль |
| Химические свойства | |
| Растворимость | |
| • в воде | 0,0086 г/100мл (при 30°C)[1] |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
Окси́д ма́гния (жжёная магнезия) — химическое соединение с формулой MgO, белые кристаллы, малорастворимые в воде, пожаро- и взрывобезопасен. Относится к классу основных оксидов. Основная форма — минерал периклаз.
Физические свойства
Легкий, рыхлый порошок белого цвета, легко впитывает воду. На этом свойстве основано его применение в спортивной гимнастике: нанесенный на ладони спортсмена, порошок предохраняет его от опасности сорваться с гимнастического снаряда.
Температура плавления — 2825 °C. Температура кипения — 3600 °C. Плотность=3,58 г/см3.
Химические свойства
Реагирует с разбавленными кислотами с образованием солей, плохо — с холодной водой, образуя Mg(OH)2:
С горячей водой реагирует лучше, реакция идет быстрее.
-
- [math]displaystyle{ mathsf{MgO + 2HCl rightarrow MgCl_2 + H_2O} }[/math]
-
- [math]displaystyle{ mathsf{MgO + H_2O rightarrow Mg(OH)_2} }[/math]
Получение
Оксид магния получают обжигом минералов магнезита и доломита, а также брусита.
- [math]ce{ CaCO3*MgCO3 -> MgO + CaO + 2CO2 }[/math]
- [math]ce{ MgCO3 -> MgO + CO2 }[/math]
- [math]ce{ Mg(OH)2 -> MgO + H2O }[/math]
Применение
В промышленности применяется для производства огнеупоров, цементов, очистки нефтепродуктов, как наполнитель при производстве резины, наполнитель в ТЭНах. Сверхлегкий оксид магния применяется как очень мелкий абразив для очистки поверхностей, в частности, в электронной промышленности.
В медицине применяют при повышенной кислотности желудочного сока, так как она обусловливается избыточным содержанием соляной кислоты. Жжёную магнезию принимают также при случайном попадании в желудок кислот.
В пищевой промышленности зарегистрирован в качестве пищевой добавки E530.
Является абсолютным отражателем — веществом с коэффициентом отражения, равным единице в широкой спектральной полосе. Может применяться как доступный эталон белого цвета.
См. также
- Стекломагниевый лист
Примечания
- ↑ Рабинович В. А., Хавин З. Я. «Краткий химический справочник». — Л.: Химия, 1978.
Литература
- Кнунянц И. Л. и др. т.2 Даффа-Меди // Химическая энциклопедия. — М.: Советская энциклопедия, 1990. — 671 с. — 100 000 экз. — ISBN 5-85270-035-5.
| п • о • р Оксиды | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| H2O | ||||||||||||||||
| Li2O LiCoO2 Li3PaO4 Li5PuO6 Ba2LiNpO6 LiAlO2 Li3NpO4 Li2NpO4 Li5NpO6 LiNbO3 |
BeO | B2O3 | С3О2 C12O9 CO C12O12 C4O6 CO2 |
N2O NO N2O3 N4O6 NO2 N2O4 N2O5 |
O | F | ||||||||||
| Na2O NaPaO3 NaAlO2 Na2PtO3 |
MgO | AlO Al2O3 NaAlO2 LiAlO2 AlO(OH) |
SiO SiO2 |
P4O P4O2 P2O3 P4O8 P2O5 |
S2O SO SO2 SO3 |
Cl2O ClO2 Cl2O6 Cl2O7 |
||||||||||
| K2O K2PtO3 KPaO3 |
CaO Ca3OSiO4 CaTiO3 |
Sc2O3 | TiO Ti2O3 TiO2 TiOSO4 CaTiO3 BaTiO3 |
VO V2O3 V3O5 VO2 V2O5 |
FeCr2O4 CrO Cr2O3 CrO2 CrO3 MgCr2O4 |
MnO Mn3O4 Mn2O3 MnO(OH) Mn5O8 MnO2 MnO3 Mn2O7 |
FeCr2O4 FeO Fe3O4 Fe2O3 |
CoFe2O4 CoO Co3O4 CoO(OH) Co2O3 CoO2 |
NiO NiFe2O4 Ni3O4 NiO(OH) Ni2O3 |
Cu2O CuO CuFe2O4 Cu2O3 CuO2 |
ZnO | Ga2O Ga2O3 |
GeO GeO2 |
As2O3 As2O4 As2O5 |
SeOCl2 SeOBr2 SeO2 Se2O5 SeO3 |
Br2O Br2O3 BrO2 |
| Rb2O RbPaO3 Rb4O6 |
SrO | Y2O3 YOF YOCl |
ZrO(OH)2 ZrO2 ZrOS Zr2О3Сl2 |
NbO Nb2O3 NbO2 Nb2O5 Nb2O3(SO4)2 LiNbO3 |
Mo2O3 Mo4O11 MoO2 Mo2O5 MoO3 |
TcO2 Tc2O7 |
Ru2O3 RuO2 Ru2O5 RuO4 |
RhO Rh2O3 RhO2 |
PdO Pd2O3 PdO2 |
Ag2O Ag2O2 |
Cd2O CdO |
In2O InO In2O3 |
SnO SnO2 |
Sb2O3 Sb2O4 Hg2Sb2O7 Sb2O5 |
TeO2 TeO3 |
I2O4 I4O9 I2O5 |
| Cs2O Cs2ReCl5O |
BaO BaPaO3 BaTiO3 BaPtO3 |
HfO(OH)2 HfO2 |
Ta2O TaO TaO2 Ta2O5 |
WO2Br2 WO2 WO2Cl2 WOBr4 WOF4 WOCl4 WO3 |
Re2O ReO Re2O3 ReO2 Re2O5 ReO3 Re2O7 |
OsO Os2O3 OsO2 OsO4 |
Ir2O3 IrO2 |
PtO Pt3O4 Pt2O3 PtO2 K2PtO3 Na2PtO3 PtO3 |
Au2O AuO Au2O3 |
Hg2O HgO (Hg3O2)SO4 Hg2O(CN)2 Hg2Sb2O7 Hg3O2Cl2 Hg5O4Cl2 |
Tl2O Tl2O3 |
Pb2O PbO Pb3O4 Pb2O3 PbO2 |
BiO Bi2O3 Bi2O4 Bi2O5 |
PoO PoO2 PoO3 |
At | |
| Fr | Ra | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | |
| ↓ | ||||||||||||||||
| La2O2S La2O3 |
Ce2O3 CeO2 |
PrO Pr2O2S Pr2O3 Pr6O11 PrO2 |
NdO Nd2O2S Nd2O3 NdHO |
Pm2O3 | SmO Sm2O3 |
EuO Eu3O4 Eu2O3 EuO(OH) Eu2O2S |
Gd2O3 | Tb | Dy2O3 | Ho2O3 Ho2O2S |
Er2O3 | Tm2O3 | YbO Yb2O3 |
Lu2O2S Lu2O3 LuO(OH) |
||
| Ac2O3 | UO2 UO3 U3O8 |
PaO PaO2 Pa2O5 PaOS |
ThO2 | NpO NpO2 Np2O5 Np3O8 NpO3 |
PuO Pu2O3 PuO2 PuO3 PuO2F2 |
AmO2 | Cm2O3 CmO2 |
Bk2O3 | Cf2O3 | Es | Fm | Md | No | Lr |



