В неорганической химии существует три основных класса соединений. Это кислоты, щелочи и оксиды. Кислота состоит из катиона водорода и аниона кислотного остатка. Щелочь — из катиона металла и гидроксильной группы. Об оксидах мы поговорим подробнее далее.
Что такое оксид?
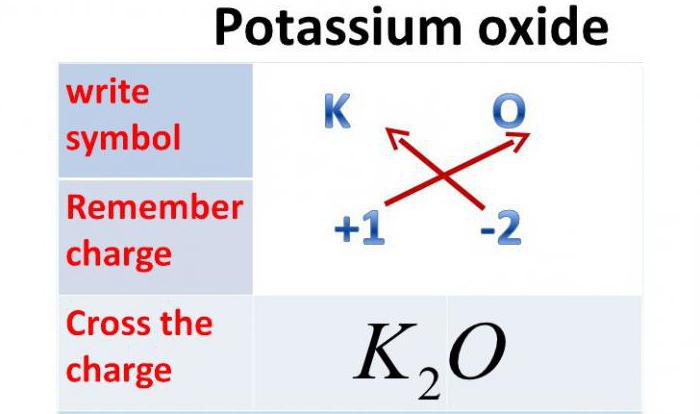
Это соединение, состоящее из двух разных химических элементов, одним из которых является кислород. Вторым же может быть металл или неметалл. Количество атомов кислорода зависит от валентности второго химического элемента, входящего в состав соединения. Так, например, валентность калия равна одному, поэтому оксид калия будет содержать один атом кислорода и два атома калия. Валентность кальция равна двум, поэтому его оксид будет состоять из одного атома кислорода и одного атома кальция. Валентность фосфора равна пяти, поэтому его оксид состоит из двух атомов фосфора и пяти атомов кислорода.
В этой статье мы более подробно поговорим про оксид калия. А именно — о его физических и химических свойствах, о его применении в различных областях промышленности.
Оксид калия: формула
Так как валентность данного металла равна одному, а валентность кислорода — двум, то это химическое соединение будет состоять из двух атомов металла и одного атома Оксигена. Итак, оксид калия: формула — К2О.
Физические свойства
Рассматриваемый оксид обладает бледно-желтой окраской. Иногда он может быть и бесцветным. При комнатной температуре он обладает твердым агрегатным состоянием.
Температура плавления данного вещества равняется 740 градусам Цельсия.
Плотность составляет 2,32 г/см3.
При термическом разложении данного оксида образуется пероксид этого же металла и чистый калий.
Растворим в органических растворителях.
В воде не растворяется, а вступает в реакцию с ней.
Обладает высокой гигроскопичностью.
Химические свойства К2О
Данное вещество обладает типичными для всех основных оксидов химическими свойствами. Рассмотрим химические реакции данного оксида с различными веществами по порядку.
Реакция с водой
В первую очередь оно способно реагировать с водой с образованием в результате гидроксида данного металла.
Уравнение такой реакции выглядит следующим образом:
- К2О + Н2О = 2КОН
Зная молярную массу каждого из веществ, из уравнения можно сделать следующий вывод: из 94 граммов рассматриваемого оксида и 18 граммов воды можно получить 112 граммов калий гидроксида.
С другими оксидами
Кроме того, рассматриваемый оксид способен реагировать с диоксидом карбона (углекислым газом). При этом образуется соль — карбонат калия.
Уравнение реакции оксида калия и оксида карбона можно записать следующим образом:
- К2О + СО2 = К2СО3
Так, можно сделать вывод, что из 94 граммов рассматриваемого оксида и 44 граммов углекислого газа получается 138 граммов калий карбоната.
Также рассматриваемый оксид может вступать в реакцию с оксидом сульфура. При этом образуется другая соль — калий сульфат.
Взаимодействие оксида калия с оксидом сульфура можно выразить следующим уравнением:
- К2О + SO3 = K2SO4
Из него видно, что, взяв 94 грамма рассматриваемого оксида и 80 граммов оксида сульфура, можно получить 174 грамма сульфата калия.
Таким же образом К2О может реагировать и с другими оксидами.
Другой тип взаимодействия — реакции не с кислотными, а с амфотерными оксидами. В таком случае образуется не кислота, а соль. Примером такого химического процесса может служить взаимодействие рассматриваемого оксида с оксидом цинка.
Эту реакцию можно выразить следующим уравнением:
- К2О + ZnO = K2ZnO2
Из него видно, что при взаимодействии рассматриваемого оксида и оксида цинка образуется соль под названием калий цинкат. Если знать молярную массу всех веществ, то можно подсчитать, что из 94 граммов К2О и 81 грамма оксида цинка можно получить 175 граммов калий цинката.
Также К2О способен взаимодействовать с оксидом азота. При этом образуется смесь из двух солей: нитрата и нитрита калия. Уравнение этой реакции выглядит таким образом:
- К2О + 2NO2 = KNO3 + KNO2
Если знать молярные массы веществ, можно сказать, что из 94 граммов рассматриваемого оксида и 92 граммов оксида нитрогена можно получить 101 грамм нитрата и 85 граммов нитрита.
Взаимодействие с кислотами
Самый распространенный случай — оксид калия + серная кислота = сульфат калия + вода. Уравнение реакции выглядит таким образом:
- К2О + H2SO4 = K2SO4 + Н2О
Из уравнения можно сделать вывод, что для получения 174 граммов сульфата калия и 18 граммов воды необходимо взять 94 грамма рассматриваемого оксида и 98 граммов серной кислоты.
Похожим образом происходит химическое взаимодействие между рассматриваемым оксидом и азотной кислотой. При этом образуется нитрат калия и вода. Уравнение этой реакции можно записать следующим образом:
- 2К2О + 4HNO3 = 4KNO3 + 2Н2О
Таким образом, из 188 граммов рассматриваемого оксида и 252 граммов азотной кислоты можно получить 404 грамма нитрата калия и 36 граммов воды.
По такому же принципу рассматриваемый оксид может реагировать и с другими кислотами. В процессе этого будут образовываться другие соли и вода. Так, к примеру, при реакции этого оксида с фосфорной кислотой получается фосфат и вода, с хлоридной кислотой — хлорид и вода и так далее.
К2О и галогены
Рассматриваемое химическое соединение способно реагировать и с веществами данной группы. К галогенам относятся простые соединения, состоящие из нескольких атомов одного и того же химического элемента. Это, например, хлор, бром, иод и некоторые другие.
Итак, хлор и оксид калия: уравнение:
- К2О + СІ2 = КСІ + КСІО
В результате такого взаимодействия образуется две соли: хлорид и гипохлорит калия. Из 94 грамм рассматриваемого оксида и 70 грамм хлора получается 74 грамма хлорида калия и 90 грамм гипохлорита калия.
Взаимодействие с аммиаком
К2О способен реагировать с этим веществом. В результате такого химического взаимодействия образуется гидроксид и амид калия. Уравнение данной реакции выглядит следующим образом:
- К2О + NH3 = КОН + KNH2
Зная молярные массы всех веществ, можно вычислить пропорции реагентов и продуктов реакции. Из 94 граммов рассматриваемого оксида и 17 граммов аммиака можно получить 56 граммов гидроксида калия и 55 граммов амида калия.
Взаимодействие с органическими веществами
Из органических химических веществ оксид калия взаимодействует с эфирами и спиртами. Однако эти реакции идут медленно и требуют специальных условий.
Получение К2О
Данное химическое вещество можно получать несолькими способами. Вот самые распространенные из них:
- Из нитрата калия и металлического калия. Эти два реагента нагревают, в результате чего образуется К2О и азот. Уравнение реакции выглядит следующим образом: 2KNO3 + 10К = N2 + 6К2О.
- Второй способ происходит в два этапа. Сначала происходит реакция между калием и кислородом, в результате чего образуется пероксид калия. Уравнение реакции выглядит так: 2К + О2 = К2О2. Далее пероксид обогащают калием, в результате чего и получают оксид калия. Уравнение реакции можно записать таким образом: К2О2 + 2К = 2К2О.
Использование К2О в промышленности
Наиболее часто рассматриваемое вещество используется в сельскохозяйственной промышленности. Данный оксид является одним из компонентов минеральных удобрений. Калий очень важен для растений, так как повышает их стойкость к различным заболеваниям. Также рассматриваемое вещество применяется в строительстве, так как может присутствовать в составе некоторых видов цемента. Кроме того, оно применяется в химической промышленности для получения других соединений калия.
Пример вопроса
Аноним
Русский язык
7 минут назад
Какой синоним к слову «Мореплаватель»?
Хороший ответ
Вася Иванов
Мореплаватель — имя существительное, употребляется в мужском роде. К нему может быть несколько синонимов.
1. Моряк. Старый моряк смотрел вдаль, думая о предстоящем опасном путешествии;
2. Аргонавт. На аргонавте были старые потертые штаны, а его рубашка пропиталась запахом моря и соли;
3. Мореход. Опытный мореход знал, что на этом месте погибло уже много кораблей, ведь под водой скрывались острые скалы;
4. Морской волк. Старый морской волк был рад, ведь ему предстояло отчалить в долгое плавание.
Плохой ответ
Аноним
Ну, синоним это такое слово, которое очень похоже на другое по своему обозначению. Тут может подойти что-то связанное с морем.
Оксид калия K2O— Бинарное неорганическое вещество. Белый, термически устойчивый.
Относительная молекулярная масса Mr = 94,20; относительная плотность для тв. и ж. состояния d = 2,33; tпл = 740º C при избыточном давлении.
1. Оксид калия можно получить путем взаимодействия калия и гидроксида калия при 450º С, в результате образуется оксид калия и водород:
2K + 2KOH = 2K2O + H2
2. При взаимодействии надпероксида калия и калия при температуре 700º C и избыточном давлении образуется оксид калия:
KO2 + 3K = 2K2O
1. При разложении оксида калия образуется пероксид калия и калий, температура при этом должна быть 350–430º С:
2K2O = K2O2 + 2K
2. Оксид калия взаимодействует со сложными веществами:
2.1. Оксид калия реагирует с водой. Образуется гидроксид калия:
K2O + H2O = 2KOH
2.2. Оксид калия взаимодействует с кислотами. При этом образуются соль и вода.
Например, оксид калия с разбавленной соляной кислотой образует хлорид калия и воду:
K2O + 2HCl = 2KCl + H2O.
2.3. При взаимодействии калия с оксидами образуются соли.
2.3.1. Реагируя с углекислым газом при 400º C оксид калия образует карбонат калия:
K2O + CO2 = K2CO3
2.3.2. При 150–200º C, в результате взаимодействия оксида калия, и оксидом азота (IV) образуются нитрат калия и нитрит калия:
K2O + 2NO2 = KNO2 + KNO3
2.3.3. Оксид калия взаимодействует с оксидом алюминия при 1000º С. При это образуется алюминат калия:
K2O + Al2O3 = 2KAlO2
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 23 мая 2021 года; проверки требуют 3 правки.
Перейти к навигации
Перейти к поиску
Оксид калия (окись калия) — бинарное неорганическое бледно-жёлтое, иногда бесцветное вещество, имеющее химическую формулу K2O. Относится к классу основных оксидов. Содержится в некоторых видах удобрений и цемента.
Химические свойства[править | править код]
Химически активное вещество. На воздухе расплывается, поглощает СО2, образуя карбонат калия:
Бурно реагирует с водой, образуя гидроксид калия:
Реагирует со спиртом, с эфиром. Энергично взаимодействует с галогенами, расплавленной серой, разбавленными кислотами, образуя различные соединения калия[1].
Получение[править | править код]
Оксид калия производят взаимодействием кислорода и калия, в результате реакции образуется пероксид калия, K2O2. Обогащением пероксида калием получают оксид[2]:
Более удобным способом является нагревание нитрата калия с металлическим калием:
Гидроксид калия не может быть обезвожен до оксида.
См. также[править | править код]
- Оксид натрия
Примечания[править | править код]
Оксид калия, характеристика, свойства и получение, химические реакции.
Оксид калия – неорганическое вещество, имеет химическую формулу K2O.
Краткая характеристика оксида калия
Физические свойства оксида калия
Получение оксида калия
Химические свойства оксида калия
Химические реакции оксида калия
Применение и использование оксида калия
Краткая характеристика оксида калия:
Оксид калия – неорганическое вещество бесцветного либо бледно-желтого цвета.
Так как валентность калия равна одному, то оксид калия содержит один атом кислорода и два атома калия.
Химическая формула оксида калия K2O.
В воде не растворяется, а вступает в реакцию с ней.
Растворим в органических растворителях.
Обладает высокой гигроскопичностью.
Физические свойства оксида калия:
| Наименование параметра: | Значение: |
| Химическая формула | K2O |
| Синонимы и названия иностранном языке | potassium oxide (англ.)
калия окись (рус.) |
| Тип вещества | неорганическое |
| Внешний вид | бесцветные (иногда бледно-желтый) кубические кристаллы |
| Цвет | бесцветный, иногда – бледно-желтый |
| Вкус | —* |
| Запах | — |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | твердое вещество |
| Плотность (состояние вещества – твердое вещество, при 20 °C), кг/м3 | 2320 |
| Плотность (состояние вещества – твердое вещество, при 20 °C), г/см3 | 2,32 |
| Температура кипения, °C | — |
| Температура плавления, °C | 740 |
| Температура разложения, °C | 300 |
| Гигроскопичность | высокая гигроскопичность |
| Молярная масса, г/моль | 94,196 |
* Примечание:
— нет данных.
Получение оксида калия:
Оксид калия получается в результате следующих химических реакций:
- 1. из пероксида калия:
Вначале получают пероксид калия.
2К + О2 → К2О2.
Затем пероксид калия обогащают калием.
К2О2 + 2К → 2К2О.
Напрямую оксид калия путем окисления самого калия не получается.
Химические свойства оксида калия. Химические реакции оксида калия:
Химически активное вещество.
Химические свойства оксида калия аналогичны свойствам оксидов других щелочных металлов. Поэтому для него характерны следующие химические реакции:
1. реакция оксида калия с галогенами:
К2О + СІ2 → КСІ + КСІО;
К2О + Br2 → КBr + КBrО;
К2О + I2 → КI + КIО.
Оксид калия бурно реагирует с галогенами, образуя соответственно две соли:
– хлорид калия и гипохлорит калия,
– бромид калия и гипобромит калия,
– йодид калия и гипойодит калия.
2. реакция оксида калия с водой:
К2О + Н2О → 2КОН.
Оксид калия бурно реагирует с водой, образуя гидроксид калия.
3. реакция оксида калия с оксидом углерода (углекислым газом):
К2О + СО2 → К2СО3.
Оксид калия на воздухе реагирует с углекислым газом (являющийся кислотным оксидом), образуя соль – карбонат калия.
4. реакция оксида калия с оксидом серы:
К2О + SО2 → К2SО3;
К2О + SО3 → К2SО4.
Оксид серы также является кислотным оксидом. В результате реакции образуется соответственно соль – в первом случае – сульфит калия, во втором случае – сульфат калия.
5. реакция оксида калия с оксидом кремния:
К2О + SiО2 → К2SiО3.
Оксид кремния также является кислотным оксидом. В результате реакции образуется соль – силикат калия.
Аналогично проходят реакции оксида калия и с другими кислотными оксидами.
6. реакция оксида калия с оксидом цинка:
К2О + ZnО → К2ZnО2.
Оксид цинка является амфотерным оксидом. Это значит, что как амфотерный оксид оксид цинка проявляет свойства как кислотных, так и основных соединений. В результате реакции образуется соль – цинкат калия.
Аналогично проходят реакции оксида калия и с другими амфотерными оксидами.
7. реакция оксида калия с плавиковой кислотой:
K2O + 2HF → 2KF + H2O.
В результате химической реакции получается соль – фторид калия и вода.
Аналогично проходят реакции оксида калия и с другими кислотами.
8. реакция оксида калия с бромистым водородом (бромоводородом):
K2O + 2HBr → 2KBr + H2O.
В результате химической реакции получается соль – бромид калия и вода.
9. реакция оксида калия с йодоводородом:
K2O + 2HI → 2KI + H2O.
В результате химической реакции получается соль – йодид калия и вода.
10. реакция оксида калия с жидким аммиаком:
K2O + NH3 → КОН + KNH2 (t = -50 oC).
В результате химической реакции получается гидроксид калия и амид калия.
Применение и использование оксида калия:
Оксид калия используется в сельском хозяйстве в качестве компонента минеральных удобрений, в строительстве в составе цемента, а также в химической промышленности для получения других соединений калия.
Примечание: © Фото //www.pexels.com, //pixabay.com
карта сайта
оксид калия реагирует кислота 1 2 3 4 5 вода
уравнение реакций соединения масса взаимодействие оксида калия
реакции с оксидом калия
Коэффициент востребованности
8 749
Физические свойства
Оксид калия K2O— Бинарное неорганическое вещество. Белый, термически устойчивый.
Относительная молекулярная масса Mr = 94,20; относительная плотность для тв. и ж. состояния d = 2,33; tпл = 740º C при избыточном давлении.
Способ получения
1. Оксид калия можно получить путем взаимодействия калия и гидроксида калия при 450º С, в результате образуется оксид калия и водород:
2K + 2KOH = 2K2O + H2
2. При взаимодействии надпероксида калия и калия при температуре 700º C и избыточном давлении образуется оксид калия:
KO2 + 3K = 2K2O
Химические свойства
1. При разложении оксида калия образуется пероксид калия и калий, температура при этом должна быть 350–430º С:
2K2O = K2O2 + 2K
2. Оксид калия взаимодействует со сложными веществами:
2.1. Оксид калия реагирует с водой. Образуется гидроксид калия:
K2O + H2O = 2KOH
2.2. Оксид калия взаимодействует с кислотами. При этом образуются соль и вода.
Например, оксид калия с разбавленной соляной кислотой образует хлорид калия и воду:
K2O + 2HCl = 2KCl + H2O.
2.3. При взаимодействии калия с оксидами образуются соли.
2.3.1. Реагируя с углекислым газом при 400º C оксид калия образует карбонат калия:
K2O + CO2 = K2CO3
2.3.2. При 150–200º C, в результате взаимодействия оксида калия, и оксидом азота (IV) образуются нитрат калия и нитрит калия:
K2O + 2NO2 = KNO2 + KNO3
2.3.3. Оксид калия взаимодействует с оксидом алюминия при 1000º С. При это образуется алюминат калия:
K2O + Al2O3 = 2KAlO2
Admin2
| Оксид калия | |
 |
|
| Общие | |
|---|---|
| Химическая формула | K2O |
| Физические свойства | |
| Состояние (ст. усл.) | твёрдое |
| Молярная масса | 94.20 г/моль |
| Плотность | 2.35 г/см³ |
| Термические свойства | |
| Температура плавления | 740 °C |
| Классификация | |
| Рег. номер CAS | 12136-45-7 |
Физические свойства
Оксид калия K2O — бледно-жёлтое, иногда бесцветное, редко встречающееся вещество. Содержится в некоторых видах удобрений и цемента.
Химические свойства
Химически активное вещество. На воздухе расплывается, поглощает СО2, давая К2СО3. Бурно реагирует с водой, образуя KOH. Реагирует со спиртом, с эфиром. Энергично взаимодействует с галогенами, расплавленной серой, разбавленными кислотами, образуя различные соединения калия.[1].
Производство
Оксид калия производят взаимодействием кислорода и калия, в результате реакции образуется пероксид калия, K2O2. Обогащением пероксида калием получают оксид:[2]
- K2O2 + 2 K → 2 K2O
Более удобным способом является нагревание нитрата калия с металлическим калием:
- 2 KNO3 + 10 K → 6 K2O + N2
Гидроксид калия не может быть обезвожен до оксида.
См. также
Оксид натрия
Калий
Ссылки
- ↑ Большая Советская Энциклопедия
- ↑ Holleman, A. F.; Wiberg, E. «Inorganic Chemistry» Academic Press: San Diego, 2001. ISBN 0-12-352651-5.
Potassium oxide is an ionic mixture of potassium and oxygen. It serves as a basis. This pale yellow solid is the most basic form of potassium oxide. It’s a highly reactive compound that you’ll only come into on rare occasions. Some industrial commodities, such as fertilisers and cement, are tested using the percent content of K2O as a reference. When potassium is oxidised, the oxide, K2O, is formed as a grey crystalline substance; potassium is burned in excess oxygen to generate potassium oxide. When dissolved in water, potassium oxide is a very corrosive alkali.
What is Potassium Oxide?
K2O is the chemical formula for potassium oxide, an inorganic molecule. When metallic potassium combines with oxygen, it produces this substance. Potassium oxide is an alkaline substance. It interacts strongly with moisture to generate potassium hydroxide due to its deliquescent nature. It decomposes at temperatures exceeding 300 degrees Celsius.
Structure of Potassium Oxide
Two atoms of potassium and one atom of oxygen make up the potassium Oxide formula. Bonds link these atoms together. The oxidation state of potassium is +1. The oxidation state of oxygen is -2. Two atoms of potassium unite with one atom of oxygen to balance the valency.
Preparation of Potassium Oxide
- The interaction between oxygen and potassium produces potassium oxide, which is then converted to potassium peroxide, K2O2. The oxide is produced by treating peroxide with potassium:
K2O2 + 2K ⇢ 2K2O
- K2O can also be made by heating potassium nitrate with metallic potassium, which is a more convenient method:
2KNO3 + 10K ⇢ 6K2O + N2
- Another option is to heat potassium peroxide to 500°C when it decomposes into pure potassium oxide and oxygen.
2K2O2 ⇢ 2K2O + O2
- Although potassium hydroxide cannot be dehydrated further to make potassium oxide, it can react with molten potassium to do so, releasing hydrogen as a byproduct.
2KOH + 2K ⇌ 2K2O + H2
Physical Properties of Potassium Oxide
- It has a pale yellow tint and is solid.
- 94.2 g/mol is the molecular weight.
- It has a density of 2.35 gm/cm3.
- Potassium oxide has a melting point of 740°C.
- It can be dissolved in ether and ethanol.
Chemical Properties of Potassium Oxide
- Potassium oxide is formed when potassium is burned in the atmosphere (O2).
4K + O2 → 2K2O
- When potassium hydroxide is combined with water, the result is potassium hydroxide.
K2O + H2O → KOH
- When it comes into contact with a strong acid, it produces salt and water.
K2O + HCl → KCl + H2O
- Potassium can be added to water immediately.
2K + 2H2O → 2KOH + H2
Uses of Potassium Oxide
- It is used as a fertiliser in agriculture, but it may also be used to make glass and soap, and in tiny amounts, it can be utilised for medical purposes.
- It is highly stable and insoluble in water. It’s very important in the ceramics industry because of this. It’s utilised in aircraft to make lightweight bowls and structural compositions.
- It’s been used to treat actinomycosis and actinobacillosis in cattle for over a century, and it’s also used to treat sporotrichosis and botryomycosis.
- It’s used to treat zygomycetes and other fungal infections.
- It’s also used to treat disorders that affect animals.
Sample Questions
Question 1: What is potassium oxide used for?
Answer:
It is frequently utilised as a fertiliser in the agriculture industry. Potassium oxide is also utilised in soap production and glass production. Potassium oxide is also known to be involved in some medicinal procedures.
Question 2: Is potassium oxide acidic or basic?
Answer:
A basic oxide is potassium oxide. FeO (iron oxide) and CaO (calcium oxide) are two other major basic oxides (calcium oxide).
Question 3: What happens when Potassium is Exposed to Air?
Answer:
During the reaction, three chemicals are formed: potassium oxide, potassium peroxide, and potassium superoxide. In the presence of oxygen, potassium is an extremely active metal that reacts violently. Potassium oxidises more quickly than the majority of metals, forming oxides containing oxygen-oxygen bonds.
8K + 4O2 → 2K2O+ 2KO2 + K2O2
Question 4: What is Potassium Hydroxide used for?
Answer:
In the agricultural industry, it is utilised as a fertiliser. It is water insoluble. This makes it valuable in sectors such as ceramics, glass, and optics. It’s utilised in the production of medications for animal ailments and fungal infections in humans. It’s utilised in the production of soap.
Question 5: How does Potassium Oxide react with Sulphuric Acid?
Answer:
Sulphuric acid interacts with potassium oxide to produce potassium sulphate and water. The reaction’s chemical equation is as follows:
K2O + H2SO4 → K2SO4 + H2O
Potassium oxide is an ionic mixture of potassium and oxygen. It serves as a basis. This pale yellow solid is the most basic form of potassium oxide. It’s a highly reactive compound that you’ll only come into on rare occasions. Some industrial commodities, such as fertilisers and cement, are tested using the percent content of K2O as a reference. When potassium is oxidised, the oxide, K2O, is formed as a grey crystalline substance; potassium is burned in excess oxygen to generate potassium oxide. When dissolved in water, potassium oxide is a very corrosive alkali.
What is Potassium Oxide?
K2O is the chemical formula for potassium oxide, an inorganic molecule. When metallic potassium combines with oxygen, it produces this substance. Potassium oxide is an alkaline substance. It interacts strongly with moisture to generate potassium hydroxide due to its deliquescent nature. It decomposes at temperatures exceeding 300 degrees Celsius.
Structure of Potassium Oxide
Two atoms of potassium and one atom of oxygen make up the potassium Oxide formula. Bonds link these atoms together. The oxidation state of potassium is +1. The oxidation state of oxygen is -2. Two atoms of potassium unite with one atom of oxygen to balance the valency.
Preparation of Potassium Oxide
- The interaction between oxygen and potassium produces potassium oxide, which is then converted to potassium peroxide, K2O2. The oxide is produced by treating peroxide with potassium:
K2O2 + 2K ⇢ 2K2O
- K2O can also be made by heating potassium nitrate with metallic potassium, which is a more convenient method:
2KNO3 + 10K ⇢ 6K2O + N2
- Another option is to heat potassium peroxide to 500°C when it decomposes into pure potassium oxide and oxygen.
2K2O2 ⇢ 2K2O + O2
- Although potassium hydroxide cannot be dehydrated further to make potassium oxide, it can react with molten potassium to do so, releasing hydrogen as a byproduct.
2KOH + 2K ⇌ 2K2O + H2
Physical Properties of Potassium Oxide
- It has a pale yellow tint and is solid.
- 94.2 g/mol is the molecular weight.
- It has a density of 2.35 gm/cm3.
- Potassium oxide has a melting point of 740°C.
- It can be dissolved in ether and ethanol.
Chemical Properties of Potassium Oxide
- Potassium oxide is formed when potassium is burned in the atmosphere (O2).
4K + O2 → 2K2O
- When potassium hydroxide is combined with water, the result is potassium hydroxide.
K2O + H2O → KOH
- When it comes into contact with a strong acid, it produces salt and water.
K2O + HCl → KCl + H2O
- Potassium can be added to water immediately.
2K + 2H2O → 2KOH + H2
Uses of Potassium Oxide
- It is used as a fertiliser in agriculture, but it may also be used to make glass and soap, and in tiny amounts, it can be utilised for medical purposes.
- It is highly stable and insoluble in water. It’s very important in the ceramics industry because of this. It’s utilised in aircraft to make lightweight bowls and structural compositions.
- It’s been used to treat actinomycosis and actinobacillosis in cattle for over a century, and it’s also used to treat sporotrichosis and botryomycosis.
- It’s used to treat zygomycetes and other fungal infections.
- It’s also used to treat disorders that affect animals.
Sample Questions
Question 1: What is potassium oxide used for?
Answer:
It is frequently utilised as a fertiliser in the agriculture industry. Potassium oxide is also utilised in soap production and glass production. Potassium oxide is also known to be involved in some medicinal procedures.
Question 2: Is potassium oxide acidic or basic?
Answer:
A basic oxide is potassium oxide. FeO (iron oxide) and CaO (calcium oxide) are two other major basic oxides (calcium oxide).
Question 3: What happens when Potassium is Exposed to Air?
Answer:
During the reaction, three chemicals are formed: potassium oxide, potassium peroxide, and potassium superoxide. In the presence of oxygen, potassium is an extremely active metal that reacts violently. Potassium oxidises more quickly than the majority of metals, forming oxides containing oxygen-oxygen bonds.
8K + 4O2 → 2K2O+ 2KO2 + K2O2
Question 4: What is Potassium Hydroxide used for?
Answer:
In the agricultural industry, it is utilised as a fertiliser. It is water insoluble. This makes it valuable in sectors such as ceramics, glass, and optics. It’s utilised in the production of medications for animal ailments and fungal infections in humans. It’s utilised in the production of soap.
Question 5: How does Potassium Oxide react with Sulphuric Acid?
Answer:
Sulphuric acid interacts with potassium oxide to produce potassium sulphate and water. The reaction’s chemical equation is as follows:
K2O + H2SO4 → K2SO4 + H2O
From Wikipedia, the free encyclopedia

|
|
| Names | |
|---|---|
| IUPAC name
potassium oxide |
|
| Systematic IUPAC name
potassium oxidopotassium |
|
| Other names
potash |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChEBI |
|
| ChemSpider |
|
| ECHA InfoCard | 100.032.012 |
| EC Number |
|
| MeSH | Potassium+oxide |
|
PubChem CID |
|
| UNII |
|
| UN number | 2033 |
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
K2O |
| Molar mass | 94.196 g·mol−1 |
| Appearance | Pale yellow solid |
| Odor | Odorless |
| Density | 2.32 g/cm3 (20 °C)[1] 2.13 g/cm3 (24 °C)[2] |
| Melting point | 740 °C (1,360 °F; 1,010 K)[2] decomposes from 300 °C[1] |
|
Solubility in water |
Reacts[1] forming KOH |
| Solubility | Soluble in diethyl ether[2] |
| Structure | |
|
Crystal structure |
Antifluorite cubic, cF12[3] |
|
Space group |
Fm3m, No. 225[3] |
|
Lattice constant |
a = 6.436 Å[3] α = 90°, β = 90°, γ = 90° |
|
Coordination geometry |
Tetrahedral (K+) Cubic (O2−) |
| Thermochemistry | |
|
Heat capacity (C) |
83.62 J/mol·K[4] |
|
Std molar |
94.03 J/mol·K[4] |
|
Std enthalpy of |
−363.17 kJ/mol[1][4] |
|
Gibbs free energy (ΔfG⦵) |
−322.1 kJ/mol[1] |
| Hazards | |
| Occupational safety and health (OHS/OSH): | |
|
Main hazards |
Corrosive, reacts violently with water |
| GHS labelling: | |
|
Pictograms |

|
|
Signal word |
Danger |
|
Hazard statements |
H314 |
|
Precautionary statements |
P260, P264, P280, P301+P330+P331, P303+P361+P353, P304+P340, P305+P351+P338, P310, P321, P363, P405, P501 |
| NFPA 704 (fire diamond) |
3 0 1
|
| Safety data sheet (SDS) | ICSC 0769 |
| Related compounds | |
|
Other anions |
Potassium sulfide Potassium selenide Potassium telluride Potassium polonide |
|
Other cations |
Lithium oxide Sodium oxide Rubidium oxide Caesium oxide |
|
Related potassium oxides |
Potassium peroxide Potassium superoxide Potassium ozonide |
|
Related compounds |
Potassium hydroxide |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Potassium oxide (K2O) is an ionic compound of potassium and oxygen. It is a base. This pale yellow solid is the simplest oxide of potassium. It is a highly reactive compound that is rarely encountered. Some industrial materials, such as fertilizers and cements, are assayed assuming the percent composition that would be equivalent to K2O.
Production[edit]
Potassium oxide is produced from the reaction of oxygen and potassium; this reaction affords potassium peroxide, K2O2. Treatment of the peroxide with potassium produces the oxide:[5]
Alternatively and more conveniently, K2O is synthesized by heating potassium nitrate with metallic potassium:
Other possibility is to heat potassium peroxide at 500 °C which decomposes at that temperature giving pure potassium oxide and oxygen.
Potassium hydroxide cannot be further dehydrated to the oxide but it can react with molten potassium to produce it, releasing hydrogen as a byproduct.
Properties and reactions[edit]
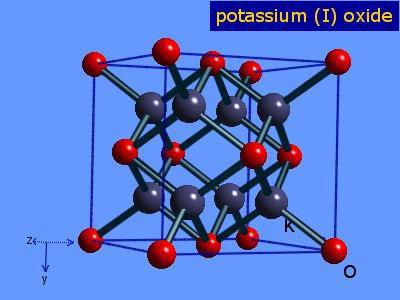
K2O crystallises in the
antifluorite structure. In this motif the positions of the anions and cations are reversed relative to their positions in CaF2, with potassium ions coordinated to 4 oxide ions and oxide ions coordinated to 8 potassium.[6][7] K2O is a basic oxide and reacts with water violently to produce the caustic potassium hydroxide. It is deliquescent and will absorb water from the atmosphere, initiating this vigorous reaction.
Term use in industry[edit]
The chemical formula K2O (or simply ‘K’) is used in several industrial contexts: the N-P-K numbers for fertilizers, in cement formulas, and in glassmaking formulas. Potassium oxide is often not used directly in these products, but the amount of potassium is reported in terms of the K2O equivalent for whatever type of potash was used, such as potassium carbonate. For example, potassium oxide is about 83% potassium by weight, while potassium chloride is only 52%. Potassium chloride provides less potassium than an equal amount of potassium oxide. Thus, if a fertilizer is 30% potassium chloride by weight, its standard potassium rating, based on potassium oxide, would be only 18.8%.
References[edit]
- ^ a b c d e Anatolievich, Kiper Ruslan. «potassium oxide». chemister.ru. Retrieved 2014-07-04.
- ^ a b c Lide, David R., ed. (2009). CRC Handbook of Chemistry and Physics (90th ed.). Boca Raton, Florida: CRC Press. ISBN 978-1-4200-9084-0.
- ^ a b c Wyckoff, Ralph W.G. (1935). The Structure of Crystals. American Chemical Society (2nd ed.). Reinhold Publishing Corp. p. 25.
- ^ a b c Dipotassium oxide in Linstrom, Peter J.; Mallard, William G. (eds.); NIST Chemistry WebBook, NIST Standard Reference Database Number 69, National Institute of Standards and Technology, Gaithersburg (MD) (retrieved 2014-07-04)
- ^ Holleman, A. F.; Wiberg, E. «Inorganic Chemistry» Academic Press: San Diego, 2001. ISBN 0-12-352651-5.
- ^ Zintl, E.; Harder, A.; Dauth B. (1934). «Gitterstruktur der oxyde, sulfide, selenide und telluride des lithiums, natriums und kaliums». Zeitschrift für Elektrochemie und Angewandte Physikalische Chemie. 40: 588–93.
- ^ Wells, A.F. (1984) Structural Inorganic Chemistry, Oxford: Clarendon Press. ISBN 0-19-855370-6.
External links[edit]
From Wikipedia, the free encyclopedia

|
|
| Names | |
|---|---|
| IUPAC name
potassium oxide |
|
| Systematic IUPAC name
potassium oxidopotassium |
|
| Other names
potash |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChEBI |
|
| ChemSpider |
|
| ECHA InfoCard | 100.032.012 |
| EC Number |
|
| MeSH | Potassium+oxide |
|
PubChem CID |
|
| UNII |
|
| UN number | 2033 |
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
K2O |
| Molar mass | 94.196 g·mol−1 |
| Appearance | Pale yellow solid |
| Odor | Odorless |
| Density | 2.32 g/cm3 (20 °C)[1] 2.13 g/cm3 (24 °C)[2] |
| Melting point | 740 °C (1,360 °F; 1,010 K)[2] decomposes from 300 °C[1] |
|
Solubility in water |
Reacts[1] forming KOH |
| Solubility | Soluble in diethyl ether[2] |
| Structure | |
|
Crystal structure |
Antifluorite cubic, cF12[3] |
|
Space group |
Fm3m, No. 225[3] |
|
Lattice constant |
a = 6.436 Å[3] α = 90°, β = 90°, γ = 90° |
|
Coordination geometry |
Tetrahedral (K+) Cubic (O2−) |
| Thermochemistry | |
|
Heat capacity (C) |
83.62 J/mol·K[4] |
|
Std molar |
94.03 J/mol·K[4] |
|
Std enthalpy of |
−363.17 kJ/mol[1][4] |
|
Gibbs free energy (ΔfG⦵) |
−322.1 kJ/mol[1] |
| Hazards | |
| Occupational safety and health (OHS/OSH): | |
|
Main hazards |
Corrosive, reacts violently with water |
| GHS labelling: | |
|
Pictograms |

|
|
Signal word |
Danger |
|
Hazard statements |
H314 |
|
Precautionary statements |
P260, P264, P280, P301+P330+P331, P303+P361+P353, P304+P340, P305+P351+P338, P310, P321, P363, P405, P501 |
| NFPA 704 (fire diamond) |
3 0 1
|
| Safety data sheet (SDS) | ICSC 0769 |
| Related compounds | |
|
Other anions |
Potassium sulfide Potassium selenide Potassium telluride Potassium polonide |
|
Other cations |
Lithium oxide Sodium oxide Rubidium oxide Caesium oxide |
|
Related potassium oxides |
Potassium peroxide Potassium superoxide Potassium ozonide |
|
Related compounds |
Potassium hydroxide |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Potassium oxide (K2O) is an ionic compound of potassium and oxygen. It is a base. This pale yellow solid is the simplest oxide of potassium. It is a highly reactive compound that is rarely encountered. Some industrial materials, such as fertilizers and cements, are assayed assuming the percent composition that would be equivalent to K2O.
Production[edit]
Potassium oxide is produced from the reaction of oxygen and potassium; this reaction affords potassium peroxide, K2O2. Treatment of the peroxide with potassium produces the oxide:[5]
Alternatively and more conveniently, K2O is synthesized by heating potassium nitrate with metallic potassium:
Other possibility is to heat potassium peroxide at 500 °C which decomposes at that temperature giving pure potassium oxide and oxygen.
Potassium hydroxide cannot be further dehydrated to the oxide but it can react with molten potassium to produce it, releasing hydrogen as a byproduct.
Properties and reactions[edit]
K2O crystallises in the
antifluorite structure. In this motif the positions of the anions and cations are reversed relative to their positions in CaF2, with potassium ions coordinated to 4 oxide ions and oxide ions coordinated to 8 potassium.[6][7] K2O is a basic oxide and reacts with water violently to produce the caustic potassium hydroxide. It is deliquescent and will absorb water from the atmosphere, initiating this vigorous reaction.
Term use in industry[edit]
The chemical formula K2O (or simply ‘K’) is used in several industrial contexts: the N-P-K numbers for fertilizers, in cement formulas, and in glassmaking formulas. Potassium oxide is often not used directly in these products, but the amount of potassium is reported in terms of the K2O equivalent for whatever type of potash was used, such as potassium carbonate. For example, potassium oxide is about 83% potassium by weight, while potassium chloride is only 52%. Potassium chloride provides less potassium than an equal amount of potassium oxide. Thus, if a fertilizer is 30% potassium chloride by weight, its standard potassium rating, based on potassium oxide, would be only 18.8%.
References[edit]
- ^ a b c d e Anatolievich, Kiper Ruslan. «potassium oxide». chemister.ru. Retrieved 2014-07-04.
- ^ a b c Lide, David R., ed. (2009). CRC Handbook of Chemistry and Physics (90th ed.). Boca Raton, Florida: CRC Press. ISBN 978-1-4200-9084-0.
- ^ a b c Wyckoff, Ralph W.G. (1935). The Structure of Crystals. American Chemical Society (2nd ed.). Reinhold Publishing Corp. p. 25.
- ^ a b c Dipotassium oxide in Linstrom, Peter J.; Mallard, William G. (eds.); NIST Chemistry WebBook, NIST Standard Reference Database Number 69, National Institute of Standards and Technology, Gaithersburg (MD) (retrieved 2014-07-04)
- ^ Holleman, A. F.; Wiberg, E. «Inorganic Chemistry» Academic Press: San Diego, 2001. ISBN 0-12-352651-5.
- ^ Zintl, E.; Harder, A.; Dauth B. (1934). «Gitterstruktur der oxyde, sulfide, selenide und telluride des lithiums, natriums und kaliums». Zeitschrift für Elektrochemie und Angewandte Physikalische Chemie. 40: 588–93.
- ^ Wells, A.F. (1984) Structural Inorganic Chemistry, Oxford: Clarendon Press. ISBN 0-19-855370-6.