Оксиды фосфора
| Оксиды азота | Цвет | Фаза | Характер оксида |
| P2O3 Оксид фосфора (III), фосфористый ангидрид | белый | твердый | кислотный |
| P2O5 Оксид фосфора(V), фосфорный ангидрид | белый | твердый | кислотный |
Оксид фосфора (V) – это кислотный оксид. В нормальных условиях образует белые кристаллы. В парах состоит из молекул P4О10. Очень гигроскопичен (используется как осушитель газов и жидкостей).
Способы получения. Оксид фосфора (V) получают сжиганием фосфора в избытке кислорода.
4P + 5O2 → 2P2O5
Химические свойства
1. Оксид фосфора (V) – очень гигроскопичное вещество, которое используется для осушения газов. Обладая высоким сродством к воде, оксид фосфора (V) дегидратирует до ангидридов неорганические и органические кислоты.
Например, оксид фосфора (V) дегидратирует серную, азотную и уксусную кислоты:
P2O5 + H2SO4 → 2HPO3 + SO3
P2O5 + 2HNO3 → 2HPO3 + N2O5
P2O5 + 2CH3COOH → 2HPO3 + (CH3CO)2O
2. Фосфорный ангидрид является типичным кислотным оксидом, взаимодействует с водой с образованием фосфорных кислот:
P2O5 + 3H2O → 2H3PO4
В зависимости от количества воды и от других условий образуются мета-фосфорная, орто-фосфорная или пиро-фосфорная кислота:
P2O5 + 2H2O → 2H4P2O7
P2O5 + H2O → HPO3
Видеоопыт взаимодействия оксида фосфора с водой можно посмотреть здесь.
3. Как кислотный оксид, оксид фосфора (V) взаимодействует с основными оксидами и основаниями.
Например, оксид фосфора (V) взаимодействует с гидроксидом натрия. При этом образуются средние или кислые соли:
P2O5 + 6NaOH → 2Na3PO4 + 3H2O
P2O5 + 2NaOH + H2O → 2NaH2PO4
P2O5 + 4NaOH → 2Na2HPO4 + H2O
Еще пример: оксид фосфора взаимодействует с оксидом бария (при сплавлении):
P2O5 + 3BaO → Ba3(PO4)2
Admin
Оксид фосфора((V))
P2O5
образуется при сгорании фосфора:
— белое кристаллическое вещество с молекулярным строением.
Рис. (1). Оксид фосфора((V))
Оксид фосфора((V)) очень гигроскопичен. Он активно присоединяет воду, поэтому применяется для осушки газов. Это типичный кислотный оксид.
Оксид фосфора((V)) реагирует:
- с водой:
- с основными оксидами с образованием соли фосфорной кислоты:
- со щелочами с образованием соли и воды:
Водородное соединение фосфора фосфин PH3 можно получить из фосфидов:
Фосфин — ядовитый газ c неприятным запахом, самовоспламеняющийся на воздухе. Он выделяется при разложении органических веществ. С образованием и окислением фосфина связано такое природное явление, как блуждающие болотные огни.
Источники:
Рис. 1. Оксид фосфора https://cdn.pixabay.com/photo/2021/05/11/07/00/salt-6245098_960_720.jpg
Оксид фосфора (V) – неорганическое вещество, имеет химическую формулу P4O10 и P2O5.
Краткая характеристика оксида фосфора (V)
Модификации оксида фосфора (V)
Физические свойства оксида фосфора (V)
Получение оксида фосфора (V)
Химические свойства оксида фосфора (V)
Химические реакции оксида фосфора (V)
Применение и использование оксида фосфора (V)
Краткая характеристика оксида фосфора (V). Формула оксида фосфора (V):
Оксид фосфора (V) – неорганическое вещество белого цвета.
Оксид фосфора (V) содержит четыре атома фосфора и десять атомов кислорода.
Химическая формула оксида фосфора (V) P4O10 и P2O5. Для простоты записи используют последнюю формулу.
В воде не растворяется, а взаимодействует с ней, образуя кислоты.
Кислотный оксид.
Модификации оксида фосфора (V):
Твердый оксид фосфора (V) склонен к полиморфизму. Существуют три формы-модификации оксида фосфора (V): H, O`, O и G формы-модификации.
| гексагональная H-форма | орторомбическая O`-форма | орторомбическая O-форма | G-форма | |
| Состояние вещества | Кристаллический вид | Кристаллический | Кристаллический вид | Стекловидный вид |
| Характер стабильности формы | Метастабильная форма | Стабильная форма | Метастабильная форма | |
| Другие характеристики | a=0,744 нм, угол = 87°, пространственная группа R3C | a=1,63 нм, b=0,814 нм, c=0,526 нм, пространственная группа Fdd2 | a=0,923 нм, b = 0,718 нм, c = 0,494 нм, пространственная группа Pnam |
H-форма переходит в O-форму при 300-360 °C (процесс заканчивается при 378 °C).
Физические свойства оксида фосфора (V). Масса, цвет, плотность, температура и пр.:
| Наименование параметра: | Значение: |
| Химическая формула оксида фосфора (V) | P4O10 и P2O5 |
| Синонимы и названия иностранном языке | phosphorus (V) oxide (англ.)
тетрафосфора декаоксид (рус.) фосфора пентаоксид (рус.) фосфорный ангидрид (рус.) |
| Тип вещества | неорганическое |
| Внешний вид | белые тригональные кристаллы |
| Цвет оксида фосфора (V) | белый |
| Вкус | —* |
| Запах | — |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | твердое вещество |
| Плотность H-формы (состояние вещества – твердое вещество, при 20 °C), кг/м3 | 2300 |
| Плотность H-формы (состояние вещества – твердое вещество, при 20 °C), г/см3 | 2,3 |
| Плотность O`-формы (состояние вещества – твердое вещество, при 20 °C), кг/м3 | 3000 |
| Плотность O`-формы (состояние вещества – твердое вещество, при 20 °C), г/см3 | 3,0 |
| Плотность O-формы (состояние вещества – твердое вещество, при 20 °C), кг/м3 | 2720 |
| Плотность O-формы (состояние вещества – твердое вещество, при 20 °C), г/см3 | 2,72 |
| Температура сублимации H-формы, °C | 340,5 |
| Температура кипения O`-формы, °C | 605,5 |
| Температура кипения O-формы, °C | 605,5 |
| Температура плавления H-формы, °C | 420,5 (0,48 МПа) |
| Температура плавления O`-формы, °C | 580,5 (74 кПа) |
| Температура плавления O-формы, °C | 562 (58 кПа) |
| Молярная масса оксида фосфора (V), P2O5, г/моль | 141,94 |
| Молярная масса оксида фосфора (V), P4O10, г/моль | 283,88 |
Примечание:
* — нет данных.
Получение оксида фосфора (V):
Оксид фосфора (V) получают путем сжигания фосфора в избытке кислорода или воздуха.
P4 + 5O2 → P4O10 (t = 34-60 °C).
Готовый продукт состоит из смеси разных форм P4O10.
Химические свойства оксида фосфора (V). Химические реакции оксида фосфора (V):
Оксид фосфора (V) относится к кислотным оксидам.
Химические свойства оксида фосфора (V) аналогичны свойствам кислотным оксидов других неметаллов. Поэтому для него характерны следующие химические реакции:
1. реакция оксида фосфора (V) и белого фосфора:
3P4O10 + 2P4 → 5P4O6 (t = 50 °C).
В результате реакции образуются оксид фосфора (III).
2. реакция оксида фосфора (V) и натрия:
3P4O10 + 16Na → 10NaPO3 + 2Na3P (t = 300-400 °C).
В результате реакции образуются соли – метафосфат натрия и фосфид натрия.
3. реакция оксида фосфора (V) и лития:
3P4O10 + 16Li → 10LiPO3 + 2Li3P (t = 300-400 °C).
В результате реакции образуются соли – метафосфат лития и фосфид лития.
4. реакция оксида фосфора (V) и фтора:
P4O10 + 6F2 → 4POF3 + 3O2 (t = 100 °C).
В результате реакции образуются оксид-трифторид фосфора(V) и кислород.
5. реакция оксида фосфора (V) с водой:
P4O10 + 6H2O → 4H3PO4 или P2O5 + 3H2O → 2H3PO4,
P4O10 + 2H2O → 4HPO3 или P2O5 + H2O → 2HPO3.
В результате реакции образуются кислоты: в первом случае – ортофосфорная кислота, во втором – метафосфорная кислота.
6. реакция оксида фосфора (V) с оксидом кальция:
CaO + P2O5 → Ca(PO3)2,
2CaO + P2O5 → Ca2P2O7,
3CaO + P2O5 → Ca3(PO4)2 (t°).
В результате реакции образуется соль, в первом случае – метафосфат кальция, во втором – дифосфат кальция, в третьем – фосфат кальция.
7. реакция оксида фосфора (V) с оксидом натрия:
3Na2O + P2O5 → 2Na3PO4.
В результате реакции образуется соль – ортофосфат натрия.
8. реакция оксида фосфора (V) с оксидом бора:
2B2O3 + P4O10 → 4BPO4 (t°).
В результате реакции образуется соль – фосфат бора.
9. реакция оксида фосфора (V) с гидроксидом натрия:
P4O10 + 12NaOH → 4Na3PO4 + 6H2O или P2O5 + 6NaOH → 2Na3PO4 + 3H2O.
В результате реакции образуется соль – ортофосфат натрия и вода. Гидроксид натрия – разбавленный раствор.
10. реакция оксида фосфора (V) с плавиковой кислотой:
P4O10 + 3HF → POF3 + 3HPO3 (t = 120-170 oC).
В результате химической реакции получается оксид-трифторид фосфора и метафосфорная кислота.
11. реакция оксида фосфора (V) с бромистым водородом (бромоводородом):
P4O10 + 3HBr → POBr3 + 3HPO3 (t = 200 oC).
В результате химической реакции получается оксид-трибромид фосфора и метафосфорная кислота.
12. реакция оксида фосфора (V) с азотной кислотой:
4HNO3 + P4O10 → 2N2O5 + 4HPO3 или 2HNO3 + P2O5 → N2O5 + 2HPO3 (t = -10 oC).
В результате химической реакции получается оксид азота и метафосфорная кислота.
13. реакция оксида фосфора (V) с ортофосфорной кислотой:
P4O10 + 8H3PO4 → 6H4P2O7 (t = 80-100 oC).
В результате химической реакции получается дифосфорная кислота. Ортофосфорная кислота – концентрированный раствор.
14. реакция оксида фосфора (V) с пероксидом водорода:
P4O10 + 8H2O2 → 4H3PO2(O2)2 + 2H2O (t = -20 oC).
В результате химической реакции получается дипероксодиоксофосфата водорода и вода. Пероксид водорода – безводный.
15. реакции оксида фосфора (V) с органическими веществами:
Оксид фосфора (V) реагирует с амидами, превращая их в нитрилы, а также со спиртами, эфирами, фенолами и другими органическими соединениями, при этом образуются фосфорорганические соединения.
Применение и использование оксида фосфора (V):
Оксид фосфора (V) используется как осушитель газов и жидкостей в органическом синтезе.
Примечание: © Фото //www.pexels.com, //pixabay.com
оксид фосфора (V) реагирует кислота 1 2 3 4 5 вода
уравнение реакций соединения масса взаимодействие оксида фосфора (V)
реакции с оксидом фосфора (V)
Коэффициент востребованности
8 712
| Оксид фосфора(V) | |
 |
|
 |
|
| Общие | |
|---|---|
| Систематическое наименование | Оксид фосфора(V) |
| Химическая формула | P2O5 |
| Отн. молек. масса | 283.889 а. е. м. |
| Молярная масса | 283.889 г/моль |
| Физические свойства | |
| Плотность вещества | 2.39 г/см³ |
| Состояние (ст. усл.) | белый порошок |
| Термические свойства | |
| Температура плавления | 420оС(Н-форма),569 (О-форма) °C |
| Температура кипения | возгоняется при 359 (Н-форма) °C |
| Энтальпия (ст. усл.) | -3010,1 кДж/моль |
| Химические свойства | |
| Растворимость в воде | реагирует г/100 мл |
| Классификация | |
| номер CAS | [1314-56-3] (P2O5) [16752-60-6] (P4O10) |
Пентаокс́ид фосфора (фо́сфорный ангидрид, пятиокись фосфора, оксид (V) фосфора — P2O5, кислотный оксид.
Содержание
- 1 Строение
- 2 Свойства
- 3 Получение
- 4 Применение
- 5 Литература
Строение
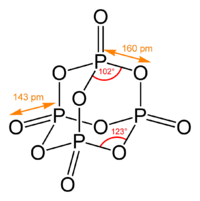
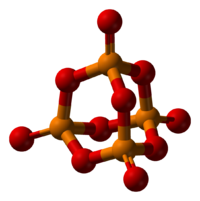
Пары оксида фосфора (V) имеют состав P4O10. Твердый оксид склонен к полиморфизму. Существует в аморфоном стекловидном состоянии и кристаллическом. Для кристаллического состояния известны две метастабильные модификации пентаоксида фосфора — гексагональная Н-форма (а = 0,744 нм, = 87°, пространств, гр. R3С) и орторомбическая О-форма (а = 0,923 нм, b — 0,718 нм, с = 0,494 нм, пространств, гр. Рпат), а также одна стабильная орторомбическая О-форма (а =1,63 нм, b= 0,814 нм, с =0,526 нм, пространств. гр. Fdd2). Молекулы P4O10 (Н-форма) построены из 4 групп PO4 в виде тетраэдра, вершины которого занимают атомы фосфора, 6 атомов кислорода располагаются вдоль ребер, а 4 — по оси третьего порядка тетраэдра. Эта модификация легко возгоняется (360оС) и активно взаимодействует с водой.
Другие модификации имеют слоистую полимерную структуру, также построенную из тетраэдров PO4, объединенные в 10-членные (О-форма) и 6-членные (О’-форма) кольца. Эти модификации имеют более высокую температуру возгонки (~580оС) и менее химически активны. H-форма переходит в О-форму при 300-360оC.
Свойства
P4O10 очень активно взаимодействует с водой (H-форма поглощает воду даже со взрывом), образуя смеси фосфорных кислот, состав которых зависит от количества воды и других условий:
- P4O10 + 6H2O (ж) → 4H3PO4 (-177 кДж)
Он также способен извлекать воду из других соединений, представляя собой сильное дегидратирующее средство:
- 2HNO3 + P2O5 → 2HPO3 + N2O5;
- 4HClO4 + P4O10 → (НРО3)4 + 2Cl2O7.
Оксид фосфора (V) широко применяется в органическом синтезе. Он реагирует с амидами, превращая их в нитрилы:
- P4O10 + RC(O)NH2 → P4O9(OH)2 + RCN
Карбоновые кислоты переводит в соотвествующие ангидриды:
- P4O10 + RCO2H → P4O9(OH)2 + [RC(O)]2O
Также взаимодействует со спиртами, эфирами, фенолами и другими органическими соединениями. При этом происходит разрыв связей P—О—P и образуются фосфорорганические соединения. Реагирует с NH3 и с галогеноводородами, образуя фосфаты аммония и оксигалогениды фосфора:
- P4O10 + 8PCl3 + O2 → 12Cl3PO
При сплавлении P4O10 с основными оксидами образует различные твердые фосфаты, природа которых зависит от условий реакции.
Получение
Оксид фосфора(V) получают сжиганием фосфора. Технологический процесс происходит в камере сжигания и включает в себя окисление элементарного P предварительно осушенным воздухом, осаждение P4O10 и очистку отходящих газов. Очищают полученный пентаоксид возгонкой.
- P4 + 5O2 → P4O10 + 2984 кДж.
Технический продукт имеет вид белой снегообразной массы, состоящей из смеси разных форм P4O10.
Применение
P4O10 применяют как осушитель газов и жидкостей. Также он является промежуточным продуктом в производстве ортофосфорной киcлоты H3PO4 термическим способом.
Широко используется в органическом синтезе в реакциях дегидратации и конденсации.
Литература
- Ахметов Н. С. «Общая и неорганическая химия» М.: Высшая школа, 2001
- Реми Г. «Курс неорганической химии» М.: Иностранная литература, 1963
- Ф. Коттон, Дж. Уилкинсон «Современная неорганическая химия» М.: Мир, 1969
Wikimedia Foundation.
2010.
Информация
Традиционно содержание Фосфора в удбрениях выражают содержанием Оксида фосфора.
Все свойства Фосфора, как питательного элемента описаны в статье Фосфор.
Подробнее >>>
Химические и физические свойства
Оксид фосфора – бесцветное аморфное или стекловидное вещество, существующеев трех кристаллических, двух аморфных и двух жидких формах.[1]
Токсичное вещество. Вызывает ожоги кожи и раздражение слизистой оболочки.
Пентаоксид фосфора очень гигроскопичен. Реагирует со спиртами эфирами, фенолами, кислотами и прочими веществами. В процессе реакции с органическими веществами происходит разрыв связей фосфора с кислородом, и образуются фосфорорганические соединения. Вступает в химические реакции с аммиаком (NH3) и галогеноводородами с образованием фосфатов аммония и оксигалогенидов фосфора. С основными оксидами образует фосфаты.[3]
Трехмерная модель молекулы
Трехмерная модель молекулы

Содержание пентаоксида фосфора в почве и удобрениях
Фактически в почве имеются только соли ортофосфорной кислоты H3PO4, но в сложных удобрениях могут быть и соли мета-, пиро- и полифосфорных кислот.[4]
Основой для образования ортофосфорной кислоты является пентаоксида фосфора. Именно поэтому, а так же в связи с тем, что растения не поглощают элементарный фосфор, условлено обозначать концентрацию фосфора через содержание пентаоксида фосфора.[2]
P2O5 + 3H2O → 2H3PO4
Все встречающиеся в почве соли ортофосфорной кислоты и одновалентных катионов (NH4+, Na+, K+) и однозамещенные соли двухвалентных катионов (Ca(H2PO4)2 и Mg(H2PO4)2) растворимы в воде.
Двузамещенные соли двухвалентных катионов в воде не растворимы, но легко растворяются в слабокислых кислотах корневых выделений и органических кислотах жизнедеятельности микроорганизмов. В этой связи они так же являются хорошим источником P2O5 для растений.[4]
Поглощение пентаоксида фосфора растениями
Как указывалось выше, в природе основной источник фосфора – это соли ортофосфорнонй кислоты H3PO4. Однако после гидролиза пиро-, поли- и метафосфаты так же используются практически всеми культурами.
Гидролиз пирофосфата натрия:
Na4P2O7 + H2O + 2H+ → 2NaH2PO4 +2Na+
Гидролиз триполифосфата натрия:
Na5P3O10 + 2H2O + 2H+ → 3NaH2PO4 +2Na+
Гидролиз метафосфат иона (в кислой среде):
(PO3)66- + 3H2O → H2P3O103- + H2P2O72- + H2PO4—
Ортофосфорная кислота, будучи трехосновной отдиссоциирует три аниона H2PO—4, HPO42-, PO4 3- . В условиях слабокислой реакции среды, именно в них возделываются растения, наиболее распространен и доступен первый ион, в меньшей степени второй и практически недоступен третий. Однако люпин, гречиха, горчица, горох, донник, конопля и другие растения способны усваивать фосфор из трехзамещенных фосфатов.[4]
Некоторые растения приспособились усваивать фосфат-ион из фосфорорганических соединений (фитин, глицефосфаты и прочее). Корни данных растений выделяют особый фермент (фотофтазу), который и отщипляет анион фосфорной кислоты от органических соединений, а затем растения поглощают этот анион. К подобного рода растениям относятся горох, бобы, кукуруза. Причем фосфатазная активность возрастает в условиях фосфорного голода.
Многие растения могут питаться фосфором из очень разбавленных растворов, вплоть до 0,01 мг /л P2O5 . Естественно, что удовлетворить потребность в фосфоре растения могут только при условии постоянного возобновления в нем концентрации хотя бы такого же низкого уровня.
Опытным путем установлено, что поглощаемый корнями фосфор прежде всего идет на синтез нуклеотидов, а для дальнейшего продвижения в наземную часть фосфаты вновь поступают в проводящие сосуды корня в виде минеральных соединений.[4]
Рерасчет содержения фосфора в удобрениях
В некоторых случаях требуется рассчитать процентное содержание фосфора в удобрении, если дано содержание по P2O5. Расчет производится по формуле:
y = x,% × 30,974 (молярная масса P) × 2 / 30,974 (молярная масса P) × 2 + 15,999 (молярная масса O) × 5
где:
х – содержание P2O5 в удобрении, %;
y – содержание P в удобрении, %
Или:
y = x, % × 0,43643
Например:
в удобрении содержится 40% оксида фосфора
для пересчета процентного содержания элемента фосфор в удобрении нужно умножить массовую долю оксида в удобрении на массовую долю элемента в оксиде (для P2O5 – 0,43643): 40 * 0,43643 = 17,4572 %
Статья составлена с использованием следующих материалов:
Литературные источники:
1.
Ван Везер «Фосфор и его соединения». Монография. т. 1.: Изд-во иностранной литературы, М., 1962.
2.
Калинский А.А., Вильдфлуш И.Р., Ионас В.А. и др. – Агрохимия в вопросах и ответах – Мн.: Урожай,1991. – 240 с.: ил.
3.
Химическая энциклопедия: в пяти томах: т.1: А-Дарзана/Редкол.: Кнунянц И.Л. (гл. ред.) и др. – М.: Советская энциклопедия, 1988. – 623.: ил
4.
Ягодин Б.А., Жуков Ю.П., Кобзаренко В.И. Агрохимия / Под редакцией Б.А. Ягодина.– М.: Колос, 2002.– 584 с.: ил (Учебники и учебные пособия для студентов высших учебных заведений).
Свернуть
Список всех источников
Оксид фосфора (V): получение и свойства
| Оксиды азота | Цвет | Фаза | Характер оксида |
| P2O3 Оксид фосфора (III), фосфористый ангидрид | белый | твердый | кислотный |
| P2O5 Оксид фосфора(V), фосфорный ангидрид | белый | твердый | кислотный |
Оксид фосфора (V) – это кислотный оксид. В нормальных условиях образует белые кристаллы. В парах состоит из молекул P4О10. Очень гигроскопичен (используется как осушитель газов и жидкостей).
Способы получения. Оксид фосфора (V) получают сжиганием фосфора в избытке кислорода.
Химические свойства
1. Оксид фосфора (V) – очень гигроскопичное вещество, которое используется для осушения газов. Обладая высоким сродством к воде, оксид фосфора (V) дегидратирует до ангидридов неорганические и органические кислоты.
Например , оксид фосфора (V) дегидратирует серную, азотную и уксусную кислоты:
2. Фосфорный ангидрид является типичным кислотным оксидом , взаимодействует с водой с образованием фосфорных кислот:
В зависимости от количества воды и от других условий образуются мета-фосфорная, орто-фосфорная или пиро-фосфорная кислота:
Видеоопыт взаимодействия оксида фосфора с водой можно посмотреть здесь.
3. Как кислотный оксид, оксид фосфора (V) взаимодействует с основными оксидами и основаниями .
Например , оксид фосфора (V) взаимодействует с гидроксидом натрия. При этом образуются средние или кислые соли:
Еще пример : оксид фосфора взаимодействует с оксидом бария (при сплавлении):
Соединения фосфора
Фосфин (PH3)
Способы получения фосфина
Прямым синтезом PH3 получить нельзя.
- Фосфин получают путем водного или кислотного гидролиза фосфидов:
- Реакция диспропорционирования фосфора в щелочах:
- Разложение солей фосфония (Температура выше 80ºС):
Физические свойства фосфина
При нормальной температуре фосфин является бесцветным газом с резким чесночным запахом. В воде малорастворим, хорошо растворим в органических растворителях
Фосфин — Яд!
Химические свойства фосфина
- PH3не реагирует с водой, щелочами, аммиаком.
PH3 — Проявляет свойства сильного восстановителя.
- Вступает в реакции с кислотами – окислителями:
- С безводными кислотами образует соли:
- Окисляется кислородом. При Т
Практического значения фосфин не имеет.
Фосфиды
Способы получения
Взаимодействие фосфора с металлами:
Физические свойства, строение фосфидов
Фосфиды – представляют собой продукты взаимодействия фосфора с металлами.
Фосфиды щелочных и щелочноземельных металлов имеют ионное строение.
Химические свойства фосфидов
Фосфиды крайне неустойчивы и легко подвергаются необратимому гидролизу с образованием РН3:
Оксид фосфора (III), триоксид фосфора (P2O3)
Способы получения оксида фосфора (III)
- Р2О3 образуется при горении фосфора в недостатке кислорода или его медленном окислении:
Физические свойства оксида фосфора (III)
При комнатной температуре Р2О3 — белая воскообразная масса с неприятным запахом. Легко испаряется, его Тпл = 23,5°С
Пары существует в виде димеров Р4О6.
!Очень ядовит
Химические свойства оксида фосфора (III)
- Р2О3 как кислотный оксид при взаимодействии с водой образует фосфористую кислоту:
- Реакция диспропорционирования происходит очень бурно при растворении Р2О3в горячей воде:
- При взаимодействии Р2О3с щелочами образуются соли фосфористой кислоты:
- При взаимодействии с окислителями P2O3 проявляет восстановительные свойства:
Окисление кислородом воздуха:
Окисление галогенами:
Оксид фосфора (V), пентаоксид фосфора, фосфорный ангидрид (Р2О5)
Способы получения фосфорного ангидрида
Сжигание фосфора в избытке воздуха:
Физические свойства фосфорного ангидрида
При комнатной температуре Р2О5 — белые стеклообразные хлопья без запаха. Существует в виде димеров Р4О10.
Очень гигроскопична, при соприкосновении с воздухом расплывается в сиропообразную жидкость (НРO3). Р2О5 — самое эффективное осушающее средство и водоотнимающий агент. Применяется для осушения нелетучих веществ и газов.
Химические свойства фосфорного ангидрида
Р2О5 проявляет кислотные свойства.
Как кислотный оксид Р2О5 взаимодействует:
- с водой, с образованием различных кислот:
- с основными оксидами, с образованием фосфатов
- с щелочами, с образованием средних и кислых солей
- Фосфорный ангидрид способен отнимать у других веществ не только гигроскопическую влагу, но и химически связанную воду. Например, он дегидратирует оксокислоты, что широко используется для получения ангидридов кислот:
Фосфорные кислоты
Фосфор образует только 2 устойчивых оксида, в которых он находится в степенях окисления +5 и +3. Однако существует большое число кислот, в которых фосфор имеет валентность равную V (пять ковалентных связей) и степени окисления +5, +4, +3, +1.
Строение наиболее известных кислот выражается следующими формулами:
Наибольшее практическое значение имеют ортофосфорная (фосфорная) и ортофосфористая (фосфористая) кислоты.
Фосфористая кислота ( H3PO3)
Способы получения фосфористой кислоты
- Гидролиз галогенидов фосфора (III):
- Окисление белого фосфора хлором:
Физические свойства, строение фосфористой кислоты
Для молекулы фосфористой кислоты H3PO3 известны 2 таутомерные формы. В одной из них 2 атома водорода молекулы связаны с кислородом, а один атом водорода связан непосредственно с атомом фосфора. Такой атом водорода не может быть замещен атомами металлов, поэтому кислота является двухосновной.
В другой таутомерной форме – все три атома водорода связаны с кислородом.
Формула фосфористой кислоты выглядит следующим образом: Н2[НРО3]
При комнатной температуре H3PO3 – кристаллическое вещество без цвета, хорошо растворимое в воде, Тпл = 74°С.
Валентность фосфора в фосфористой кислота равна V, а степень окисления +3.
Химические свойства фосфористой кислоты
Является слабой кислотой.
- Для нее характерны все свойства кислот — взаимодействие с металлами с выделением Н2; с оксидами металлов и с щелочами. При этом образуются одно — или двухзамещенные фосфиты:
- Кислота является и окислителем и восстановителем, при нагревании вступая в реакции диспропорционирования:
Кислота и ее соли являются сильными восстановителями:
- Реагируют с сильными окислителями:
- Реагируют с более слабыми окислителями:
- В реакции с сильными восстановителями, например, с щелочными и щелочно-земельными металлами, цинковой пылью, кислота восстанавливается до фосфина:
- При нагревании водного раствора Н3РO3окисляется до H3PO4 с выделением водорода:
Соли фосфористой кислоты (Фосфиты)
Способы получения фосфитов
- Взаимодействие фосфористой кислоты с щелочами:
- взаимодействие фосфористой кислоты с металлами с выделением Н2
- взаимодействие фосфористой кислоты с оксидами металлов
- диспропорционирование фосфора в горячем, концентрированном растворе щелочи:
- Взаимодействие трихлорида фосфора с разбавленным раствором щелочи:
Физические свойства фосфитов
Двухосновная фосфористая кислота образует два типа солей:
а) однозамещенные фосфиты (кислые соли), в молекулах которых атомы металлов связаны с анионами Н2РО3, например: NaH2PO3, Са(H2PO3)
б) двухзамещенные фосфиты (средние соли), в молекулах которых атомы металлов связаны с 2 или 1 анионом HPO3, например: Na2HPO3, СаHPO3.
Хорошо растворимы в воде только фосфиты щелочных металлов и кальция, остальные фосфиты плохо растворимы.
Химические свойства фосфитов
Имеют химические свойства, характерные для солей
Ортофосфорная кислота, фосфорная кислота (Н3РO4)
Способы получения фосфорной кислоты
В промышленности Н3РO4 получают двумя способами:
- Разложением природного соединения – фосфата кальция Са3(РO4)2 серной кислотой:
- Доменный (термический) 3х-стадийный способ:
1 стадия — восстановление природных фосфоритов коксом
2 стадия – окисление получающихся паров свободного фосфора кислородом воздуха
3 стадия – орошение водой получающейся окиси фосфора:
Лабораторный способ
- Н3РO4 получают окислением фосфора азотной кислотой:
- Взаимодействием фосфорного ангидрида с водой:
Физические свойства, строение фосфорной кислоты
При обычной температуре безводная Н3РO4 – прозрачное, легкоплавкое (Тпл = 42°С) кристаллическое вещество. Н3РO4 -очень гигроскопичное вещество и смешивается с водой в любых соотношениях. Н3РO4 с небольшим количеством воды образует сиропообразную, вязкую жидкость.
Степень окисления фосфора в фосфорной кислоте равна +5, валентность равна V.
При нагревании орто-фосфорной кислоты выше +213 °C, она переходит в пирофосфорную H4P2O7.
При нагревании выше 700°С переходит в метафосфорную кислоту HPO3:
Качественные реакции для обнаружения фосфат-иона
Для обнаружения анионов фосфорной кислоты используют раствор AgNO3, при помощи которого также можно различить мета-, пиро- и ортофосфорные кислоты друг от друга.
При добавлении AgNO3 к кислотам образуются осадки различного цвета:
- метафосфат серебра AgPO3— белый
- пирофосфат серебра Ag4P2O7 – также белый, но он не свертывает яичного белка
- ортофосфат серебра Ag3PO4— желтый:
Химические свойства фосфорной кислоты
Фосфорная кислота H3PO4 – это электролит средней силы и представляет собой трехосновную кислоту.
Диссоциация протекает в основном по 1-й ступени:
По 2-й и 3-й ступеням диссоциация протекает в ничтожно малой степени:
- Н3РO4 проявляет все общие свойства кислот — взаимодействует с активными металлами:
- с основными оксидами:
- с основаниями образует три ряда солей – одно-, двух- и трехзамещенные (кислые и средние соли):
- с аммиаком образует соли аммония:
- Вытесняет более слабые кислоты из их солей (карбонатов, сульфидов и др.). Также вступает в обменные реакции с солями:
- При нагревании H3PO4 выше 200°С происходит отщепление молекулы воды с образованием пирофосфорной кислотыH2P2O7:
В отличие от аниона NO3 — в азотной кислоте, анион РO4 3- окисляющим действием не обладает.
Соли ортофосфорной кислоты (ортофосфаты, фосфаты)
Способы получения фосфатов
Получают кислоты с металлами, оксидами металлов, гидроксидами (см. Химические свойства ортофосфорной кислоты)
Физические свойства фосфатов
Н3РO4 является 3х-основной кислотой, поэтому образует 3 типа солей:
| Анион соли | Название | Растворимость в воде | Примеры солей |
| PO4 3- | Фосфат (ортофосфат) | большинство нерастворимы (кроме фосфатов щелочных металлов и аммония) | Na3РO4; Са3(РO4)2 |
| HPO4 2- | Гидрофосфат | растворимы | Na2НРO4; СаНРО4 |
| Н2РO4 — | Дигидрофосфат | очень хорошо растворимы | NaH2PO4; Са(Н2РO4)2 |
Химические свойства фосфатов
- Имеют свойства, характерные для солей.
- Соли щелочных металлов подвержены гидролизу:
- Характерная особенность ортофосфатов – отношение к прокаливанию: однозамещенные соли переходят в метафосфаты, двухзамещенные – в пирофосфаты, из трехзамещенных изменяются только соли аммония:
Фосфорные удобрения
Фосфаты и гидрофосфаты кальция и аммония используются в качестве фосфорных удобрений.
При достаточном количестве фосфора растения быстро растут и хорошо плодоносят. Внесение фосфорных удобрений благоприятствует росту корневой системы растения и повышению урожайности. В связи с этим такие удобрения важны при выращивании овощных, зерновых и плодово-ягодных культур.
В таблице ниже приведены основные виды фосфорных удобрений.
Категории V группа (азот, фосфор), НЕОРГАНИЧЕСКАЯ ХИМИЯ
Химические свойства оксида фосфора 5 и его применение
Оксид фосфора (V) — что это такое
Оксид фосфора (V) является кислотным оксидом. Представляет собой кристаллическое вещество белого цвета молекулярного строения.
В обычных условиях оксид фосфора (V) имеет вид белых кристаллов. В парах вещество состоит из молекул P 4 О 10 . Соединение обладает высокой степенью гигроскопичности.
Химическая формула оксида фосфора (V):
P 4 O 10 и P 2 O 5
Формулу вещества в химии записывают двумя способами. С целью упростить запись чаще используют второй вариант P 2 O 5 .
Структурные модификации оксида фосфора (V):
- кристаллическая;
- полимерная стекловидная.
В кристаллической модификации в узлах кристаллической решетки находятся молекулы P 2 O 5 , связанные попарно.
Характеристика модификаций оксида фосфора (V) с разным строением:
Химические и физические свойства
Список физических свойств оксида фосфора (V):
- соединение относят к типу неорганических веществ;
- имеет вид белых тригональных кристаллов;
- твердое агрегатное состояние при 20°C и атмосферном давлении 1 атм.;
- плотность каждой H-формы при условии, что вещество находится в твердом состоянии при комнатной температуре, равна 2 , 3 г / с м 3 ;
- плотность O`-формы при условии, что вещество находится в твердом состоянии при комнатной температуре, равна 3 г / с м 3 ;
- плотность O-формы при условии, что вещество находится в твердом состоянии при комнатной температуре, равна 2 , 72 г / с м 3 ;
- температура сублимации H-формы — 340 , 5 ° C ;
- температура кипения O`-формы — 605 , 5 ° C ;
- температура кипения O-формы — 605 , 5 ° C ;
- температура плавления H-формы — 420 , 5 ° C ( 0 , 48 М П а ) ;
- температура плавления O`-формы — 580 , 5 ° C ( 74 к П а ) ;
- температура плавления O-формы — 562 ° C ( 58 к П а ) ;
- молярная масса оксида фосфора (V) P 2 O 5 — 141 , 94 г / м о л ь ;
- молярная масса димера оксида фосфора (V) P 4 O 10 — 283 , 88 г / м о л ь .
Оксид фосфора (V) относят к группе кислотных оксидов неметаллов. К примеру, оксид кремния (IV) и оксид серы (VI) также являются кислотными оксидами.
Взаимодействие оксида фосфора (V) с белым фосфором можно описать с помощью уравнения:
3 P 4 O 10 + 2 P 4 → 5 P 4 O 6 ( t = 50 ° C )
Результатом реакции является образование оксида фосфора (III).
При соединении оксида фосфора (V) с натрием образуются соли метафосфат натрия N a P O 3 и фосфид натрия N a 3 P :
3 P 4 O 10 + 16 N a → 10 N a P O 3 + 2 N a 3 P ( t = 300 — 400 ° C )
Химическая реакция оксида фосфора (V) и лития приводит к образованию солей в виде метафосфата лития L i P O 3 и фосфида лития L i 3 P :
3 P 4 O 10 + 16 L i → 10 L i P O 3 + 2 L i 3 P ( t = 300 — 400 ° C )
При контакте оксида фосфора (V) со фтором образуются оксид-трифторид фосфора(V) и кислород:
P 4 O 10 + 6 F 2 → 4 P O F 3 + 3 O 2 ( t = 100 ° C )
Химическая реакция оксида фосфора (V) и воды протекает таким образом:
P 4 O 10 + 6 H 2 O → 4 H 3 P O 4 или P 2 O 5 + 3 H 2 O → 2 H 3 P O 4
P 4 O 10 + 2 H 2 O → 4 H P O 3 или P 2 O 5 + H 2 O → 2 H P O 3
В результате взаимодействия вещества с водой образуются кислоты. В первом примере продуктом реакции является ортофосфорная кислота H 3 P O 4 , а во втором — метафосфорная кислота H P O 3
Взаимодействие оксида фосфора (V) с оксидом кальция приводит к образованию солей:
C a O + P 2 O 5 → C a ( P O 3 ) 2
2 C a O + P 2 O 5 → C a 2 P 2 O 7
3 C a O + P 2 O 5 → C a 3 ( P O 4 ) 2 ( t ° )
В первом случае образуется метафосфат кальция C a ( P O 3 ) 2 . В результате второй химической реакции синтезируется пирофосфат кальция C a 2 P 2 O 7 , в результате третьей — фосфат кальция C a 3 ( P O 4 ) 2 .
Взаимодействие оксида фосфора (V) с оксидом натрия приводит к образованию соли в виде ортофосфата натрия:
3 N a 2 O + P 2 O 5 → 2 N a 3 P O 4
Реакция оксида фосфора (V) и оксида бора является процессом образования фосфата бора:
2 B 2 O 3 + P 4 O 10 → 4 B P O 4 ( t ° )
В процессе реакции оксида фосфора (V) и гидроксида натрия образуются соль ортофосфат натрия и вода:
P 4 O 10 + 12 N a O H → 4 N a 3 P O 4 + 6 H 2 O или P 2 O 5 + 6 N a O H → 2 N a 3 P O 4 + 3 H 2 O
Оксид фосфора (V) вступает в реакцию с плавиковой кислотой, что приводит к образованию оксида-трифторида фосфора и метафосфорной кислоты:
P 4 O 10 + 3 H F → P O F 3 + 3 H P O 3 ( t = 120 — 170 ° C ) .
Оксид фосфора (V) реагирует с бромоводородом, что в результате позволяет получить оксид-трибромид фосфора и метафосфорную кислоту:
P 4 O 10 + 3 H B r → P O B r 3 + 3 H P O 3 ( t = 200 ° C )
Взаимодействие оксида фосфора (V) с азотной кислотой с образованием оксида азота и метафосфорной кислоты:
4 H N O 3 + P 4 O 10 → 2 N 2 O 5 + 4 H P O 3 или 2 H N O 3 + P 2 O 5 → N 2 O 5 + 2 H P O 3 ( t = – 10 ° C )
Оксид фосфора (V) взаимодействует с ортофосфорной кислотой, что сопровождается образованием дифосфорной (пирофосфорной) кислоты:
P 4 O 10 + 8 H 3 P O 4 → 6 H 4 P 2 O 7 ( t = 80 — 100 ° C )
Взаимодействие оксида фосфора (V) и пероксида водорода с образованием дипероксодиоксофосфата водорода и воды:
P 4 O 10 + 8 H 2 O 2 → 4 H 3 P O 2 ( O 2 ) 2 + 2 H 2 O ( t = – 20 ° C )
В процессе реакции оксида фосфора (V) с амидами они превращаются в нитрилы. При взаимодействии вещества со спиртами, эфирами, фенолами, другими органическими соединениями образуются фосфорорганические соединения.
Получение и использование оксида фосфора (V)
Получение оксида фосфора (V) основано на горении и окислении фосфора при наличии избытка кислорода или воздуха. В результате образуется продукт, состоящий из семи различных форм P 4 O 10 .
P 4 + 5 O 2 → P 4 O 10 ( t = 34 — 60 ° C )
Практическое применение полученного в результате данной химической реакции оксида фосфора (V) заключается в его использовании для осушения газообразных и жидких веществ, в органическом синтезе (как водоотнимающее средство). Соединение активно используют в производстве такой продукции, как:
- фосфорная кислота;
- поверхностно-активные вещества;
- фосфатные стекла.
Другим соединением фосфора является фосфин. Вещество представляет собой ядовитый газ c неприятным запахом, самовоспламеняющийся на воздухе. Фосфин является продуктом разложения органических веществ.
источники:
http://zadachi-po-khimii.ru/neorganicheskaya-ximiya/soedineniya-fosfora.html
http://wika.tutoronline.ru/himiya/class/9/himicheskie-svojstva-oksida-fosfora-5-i-ego-primenenie
I. Оксид фосфора (V) – фосфорный ангидрид

Получение: Получается при горении фосфора в избытке воздуха или кислорода
4P + 5O2 = 2P2O5
Применение: Оксид фосфора (V) очень энергично соединяется с водой, а также отнимает воду от других соединений. Применяется как осушитель газов и жидкостей.
Химические свойства: Оксид фосфора (V) – это кислотный оксид, взаимодействует, подобно другим кислотным оксидам с водой, основными оксидами и основаниями.
Фосфорный ангидрид особым образом взаимодействует с водой, взаимодействуя с водой при обычных условиях (без нагревания), образует в первую очередь метафосфорную кислоту НРО3:
P2O5 + H2O = HPO3
при нагревании образуется ортофосфорная кислота H3PO4:
P2O5 + 3H2O = 2H3PO4 (t˚C)
При нагревании H3PO4 можно получить пирофосфорную кислоту H4P2O7:
2H3PO4 = H2O + H4P2O7 (t˚C)
II. Ортофосфорная кислота
Наибольшее практическое значение имеет ортофосфорная кислота Н3РO4
Строение молекулы: В молекуле фосфорной кислоты атомы водорода соединены с атомами кислорода:
Физические свойства: Фосфорная кислота представляет собой бесцветное, гигроскопичное твердое вещество, хорошо растворимое в воде.
Получение:
1) Взаимодействие оксида фосфора (V) с водой при нагревании:
P2O5 + 3H2O = 2H3PO4 (t˚C)
2) Взаимодействие природной соли – ортофосфата кальция с серной кислотой при нагревании:
Сa3(PO4)2 + 3H2SO4 = 3CaSO4 + 2H3PO4 (t˚C)
3) При взаимодействии фосфора с концентрированной азотной кислотой
3P + 5HNO3+ 2H2O = 3H3PO4+ 5NO
Химические свойства:
|
Свойства, общие с другими кислотами |
Специфические свойства |
|
1. Водный раствор кислоты изменяет окраску индикаторов на красный: Ортофосфорная кислота диссоциирует ступенчато: H3PO4 ↔ H+ + H2PO4— (дигидроортофосфат-ион) H2PO4— ↔ H+ + HPO42- (гидроортофосфат-ион) HPO42- ↔ H+ + PO43- (ортофосфат-ион) 2. Взаимодействует с металлами в ряду активности до (Н2): металл+ H3PO4= соль + Н2↑ 3. Взаимодействует с основными оксидами: оксид металла + H3PO4 = соль + Н2О 4. Взаимодействует с основаниями Ме(ОН)n: основание + H3PO4 = соль + Н2О если кислота в избытке, то образуется кислая соль: H3PO4(изб) + NaOH = NaH2PO4+ H2O или H3PO4(изб) + 2NaOH =Na2HPO4 + 2H2O 5. Реагирует с аммиаком (по донорно-акцепторному механизму), если в избытке кислота, образуются кислые соли: H3PO4 + NH3 = NH3H2PO4 H3PO4 + 2NH3 = (NH3)2HPO4 H3PO4 + 3NH3 = (NH3)3PO4 6. Реагирует с солями слабых кислот: 2H3PO4+3Na2CO3 = 2Na3PO4 + 3H2O + 3CO2↑ |
1. При нагревании ортофосфорная кислота постепенно превращается в метафосфорную кислоту: 2H3PO4 (t˚C) → H2O + H4P2O7 H4P2O7 (t˚C)→ H2O + 2HPO3 2. Качественная реакция на PO43- — фосфат ион Отличительной реакцией ортофосфорной кислоты от других фосфорных кислот является реакция с нитратом серебра — образуется жёлтый осадок: Н3РО4 + 3AgNO3 = Ag3PO4↓+ 3HNO3 3. Играет большую роль в жизнедеятельности животных и растений. Её остатки входят в состав АТФ. При разложении АТФ выделяется большое количество энергии, что очень важно для живых организмов. |
Применение:
В основном для производства минеральных удобрений.
А также, используется при пайке, для очищения от ржавчины металлических поверхностей. Также применяется в составе фреонов, в промышленных морозильных установках как связующее вещество. Ортофосфорная кислота зарегистрирована в качестве пищевой добавки E338. Применяется как регулятор кислотности в газированных напитках.
III. Минеральные удобрения
Минеральные удобрения — неорганические соединения, содержащие необходимые для растений элементы питания.
В почвах обычно имеются все необходимые растению питательные элементы. Но часто отдельных элементов бывает недостаточно для удовлетворительного роста растений. На песчаных почвах растения нередко испытывают недостаток магния, на торфяных почвах – молибдена, на черноземах – марганца и т. п. Применениеминеральных удобрений – один из основных приемов интенсивного земледелия. С помощью минеральных удобренийможно резко повысить урожаи любых культур на уже освоенных площадях без дополнительных затрат на обработку новых земель. Для внесения минеральных удобрений используются туковые сеялки.
Установлено, что в состав растений входит около 70 элементов. Некоторые из них – макроэлементы – необходимы растениям в больших количествах; другие же – микроэлементы – требуются в незначительных количествах.
1. Макроэлементы – углерод, кислород, водород, азот, фосфор, сера, магний, калий, кальций.
2. Ммкроэлементы – железо, марганец, бор , медь, цинк, молибден, кобальт и др.
Тир важнейших элемента – азот, фосфор и калий – необходимы растениям в больших количествах. Поэтому удобрения, содержащие эти элементы, получают в промышленных масштабах.
При недостатке азота задерживается образование зелёной массы, растения плохо растут, их листья желтеют. Азотные удобрения необходимы растениям в весенний период.
Фосфор необходим при росте и развитии репродуктивных органов растений (цветков, плодов).
Калий ускоряет процесс фотосинтеза и содействует накоплению углеводов (сахара – в сахарной свекле, крахмала в картофеле). У злаковых он способствует укреплению стебля и тем самым устраняет их полегание.
Железо, марганец, бор и другие микроэлементы играют определённую роль в жизни растений. Так, например, при наличии микроэлемента бора растения лучше усваивают азот, фосфор, и калий.Медь, марганец и цинк ускоряют окислительно-восстановительные процессы и тем самым способствуют росту растений. Железо участвует в синтезе хлорофилла.
Растения поглощают макро – и микроэлементы из почвенного раствора в виде ионов (NH4+, NO3—,K+ и других)
Минеральные удобрения содержат питательные вещества в виде различных минеральных солей. В зависимости от того, какие питательные элементы содержатся в них, минеральные удобренияподразделяют на простые и комплексные.
1) Простые минеральные удобрения содержат один какой-либо элемент питания (P,K, N). К ним относятся фосфорные, азотные, калийные и микроудобрения.
2) Комплексные минеральные удобрения содержат одновременно два или более основных питательных элемента.
IV. Тренажеры
Тренажёр №1. «Свойства фосфора и его соединений»
Тренажёр №2. Тестовые задания по теме: «Азот и фосфор, их соединения»
V. Закрепление
Задание №1. Составьте уравнения реакций оксида фосфора (V) с
1. Na2O
2. NaOH
3. H2O при нагревании
4. H2O без нагревания
Для 2 реакции запишите полное и краткое ионное уравнение.
Задание №2. Составьте молекулярные и ионные уравнения реакций ортофосфорной кислоты с:
1. калием
2. оксидом калия
3. гидроксидом калия
4. сульфитом калия
Задание №3. Осуществите превращения по схеме:
Сa3(PO4)2 -> P -> PH3 -> P2O5 -> H3PO4 -> Ca3(PO4)2
Назовите вещества
Задание №4. Вычислите (в %), какое из фосфорных удобрений: двойной суперфосфат или преципитат богаче фосфором? Химические формулы удобрений найдите в схеме самостоятельно.





