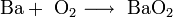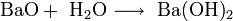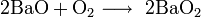| Оксид бария | |
|---|---|
| Общие | |
| Систематическое наименование |
Оксид бария |
| Традиционные названия | Оксид бария; окись бария; безводный барит |
| Хим. формула | BaO |
| Рац. формула | BaO |
| Физические свойства | |
| Состояние | твёрдое |
| Молярная масса | 153,3394 г/моль |
| Плотность | 5,72 (20 °C)[1] |
| Термические свойства | |
| Температура | |
| • плавления | 1920 °C |
| • кипения | 2000 °C |
| Энтальпия | |
| • образования | -558,1 кДж/моль |
| Классификация | |
| Рег. номер CAS | 1304-28-5 |
| Безопасность | |
| Предельная концентрация | 0,5 мг/м³ |
| ЛД50 | 146 мг/кг (крыса, внутрижелудочно) |
| Токсичность | Класс опасности 2[2] |
| Пиктограммы СГС |
|
| NFPA 704 |
0 3 2 ALK |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
Окси́д ба́рия, о́кись ба́рия — бинарное неорганическое химическое соединение металла бария с кислородом. Химическая формула [math]ce{ BaO }[/math].
Является основным оксидом. При стандартных условиях представляет собой бесцветные кристаллы с кубической кристаллической решёткой[3]. Ядовит.
Получение
1. Взаимодействие металлического бария с кислородом:
- [math]ce{ 2Ba + O2 -> 2 BaO }[/math].
В этой реакции наряду с оксидом бария образуется пероксид бария:
- [math]ce{ Ba + O2 -> BaO2 }[/math].
2. Разложение карбоната бария при нагревании:
- [math]ce{ BaCO3 -> BaO + CO2 ^ }[/math].
3. Разложение нитрата бария при нагревании:
- [math]ce{ 2 Ba(NO3)2 -> 2BaO + 4NO2 ^ + O2 ^ }[/math].
Химические свойства
1. Энергично взаимодействует с водой с образованием бариевой щёлочи и выделением тепла:
- [math]ce{ BaO + H2O -> Ba(OH)2 }[/math].
2. Взаимодействие с кислотными оксидами с образованием соли:
- [math]ce{ BaO + CO2 -> BaCO3 }[/math],
- [math]ce{ BaO + SO3 -> BaSO4 v }[/math].
3. Взаимодействие с кислотами с образованием соли и воды:
- [math]ce{ BaO + 2 HCl -> BaCl2 + H2O }[/math],
- [math]ce{ BaO + H2SO4 -> BaSO4 v + H2O }[/math].
4. Взаимодействие с кислородом при температуре около 600 °C с образованием пероксида:
- [math]ce{ 2BaO + O2 -> 2BaO2 }[/math].
5. Восстановление до металла при нагревании с магнием, цинком, алюминием и кремнием[4].
- [math]ce{ BaO + Mg -> Ba + MgO }[/math]
Применение
Поскольку работа выхода электронов из оксида бария низка, то при невысокой стоимости и технологичности он давно и широко применяется как один из компонентов покрытия катодов различных электровакуумных приборов, кинескопов, осциллографических электронно-лучевых трубок и др. Например, смесь для катодов «Radio Mix No. 3» фирмы «J. T. Baker Chemical Co.» состоит на 57,3 % из карбоната бария, который при нагревании в вакууме разлагается до оксида бария[5][6].
Также используется для производства некоторых видов неорганического стекла, например, оптического.
В некоторых реакциях оксид бария используется как катализатор.
Яркость поверхности, покрытой оксидом бария или оксидом магния, принимается за единицу при измерениях коэффициента яркости других поверхностей.
Физиологическое действие
Вещество токсично. ПДК 0,7 мг/л. При попадании на кожу и слизистые оболочки глаз в большом количестве оксид бария может вызывать химические ожоги. Пожаро- и взрывобезопасен.
ЛД50 для крыс при пероральном введении составляет 146 мг/кг.
Примечания
- ↑ [www.xumuk.ru/spravochnik/378.html Оксид бария на XuMuK.Ru]
- ↑ Оксид бария
- ↑ [www.xumuk.ru/encyklopedia/471.html Описание оксида бария на XuMuK.Ru]
- ↑ Фрумина Н. С., Горюнова Н. Н., Еременко С. Н. Аналитическая химия бария — Москва: Наука, 1977. — 200 с.
- ↑ Low power pulsed anode magnetron for improving spectrum quality
- ↑ Варламов В. А., Шехмейстер Е. И. Сборочные операции в электровакуумном производстве / М.: Высшая школа, 1974. — 360 с. С. 316—317.
| п • о • р Оксиды | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| H2O | ||||||||||||||||
| Li2O LiCoO2 Li3PaO4 Li5PuO6 Ba2LiNpO6 LiAlO2 Li3NpO4 Li2NpO4 Li5NpO6 LiNbO3 |
BeO | B2O3 | С3О2 C12O9 CO C12O12 C4O6 CO2 |
N2O NO N2O3 N4O6 NO2 N2O4 N2O5 |
O | F | ||||||||||
| Na2O NaPaO3 NaAlO2 Na2PtO3 |
MgO | AlO Al2O3 NaAlO2 LiAlO2 AlO(OH) |
SiO SiO2 |
P4O P4O2 P2O3 P4O8 P2O5 |
S2O SO SO2 SO3 |
Cl2O ClO2 Cl2O6 Cl2O7 |
||||||||||
| K2O K2PtO3 KPaO3 |
CaO Ca3OSiO4 CaTiO3 |
Sc2O3 | TiO Ti2O3 TiO2 TiOSO4 CaTiO3 BaTiO3 |
VO V2O3 V3O5 VO2 V2O5 |
FeCr2O4 CrO Cr2O3 CrO2 CrO3 MgCr2O4 |
MnO Mn3O4 Mn2O3 MnO(OH) Mn5O8 MnO2 MnO3 Mn2O7 |
FeCr2O4 FeO Fe3O4 Fe2O3 |
CoFe2O4 CoO Co3O4 CoO(OH) Co2O3 CoO2 |
NiO NiFe2O4 Ni3O4 NiO(OH) Ni2O3 |
Cu2O CuO CuFe2O4 Cu2O3 CuO2 |
ZnO | Ga2O Ga2O3 |
GeO GeO2 |
As2O3 As2O4 As2O5 |
SeOCl2 SeOBr2 SeO2 Se2O5 SeO3 |
Br2O Br2O3 BrO2 |
| Rb2O RbPaO3 Rb4O6 |
SrO | Y2O3 YOF YOCl |
ZrO(OH)2 ZrO2 ZrOS Zr2О3Сl2 |
NbO Nb2O3 NbO2 Nb2O5 Nb2O3(SO4)2 LiNbO3 |
Mo2O3 Mo4O11 MoO2 Mo2O5 MoO3 |
TcO2 Tc2O7 |
Ru2O3 RuO2 Ru2O5 RuO4 |
RhO Rh2O3 RhO2 |
PdO Pd2O3 PdO2 |
Ag2O Ag2O2 |
Cd2O CdO |
In2O InO In2O3 |
SnO SnO2 |
Sb2O3 Sb2O4 Hg2Sb2O7 Sb2O5 |
TeO2 TeO3 |
I2O4 I4O9 I2O5 |
| Cs2O Cs2ReCl5O |
BaO BaPaO3 BaTiO3 BaPtO3 |
HfO(OH)2 HfO2 |
Ta2O TaO TaO2 Ta2O5 |
WO2Br2 WO2 WO2Cl2 WOBr4 WOF4 WOCl4 WO3 |
Re2O ReO Re2O3 ReO2 Re2O5 ReO3 Re2O7 |
OsO Os2O3 OsO2 OsO4 |
Ir2O3 IrO2 |
PtO Pt3O4 Pt2O3 PtO2 K2PtO3 Na2PtO3 PtO3 |
Au2O AuO Au2O3 |
Hg2O HgO (Hg3O2)SO4 Hg2O(CN)2 Hg2Sb2O7 Hg3O2Cl2 Hg5O4Cl2 |
Tl2O Tl2O3 |
Pb2O PbO Pb3O4 Pb2O3 PbO2 |
BiO Bi2O3 Bi2O4 Bi2O5 |
PoO PoO2 PoO3 |
At | |
| Fr | Ra | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | |
| ↓ | ||||||||||||||||
| La2O2S La2O3 |
Ce2O3 CeO2 |
PrO Pr2O2S Pr2O3 Pr6O11 PrO2 |
NdO Nd2O2S Nd2O3 NdHO |
Pm2O3 | SmO Sm2O3 |
EuO Eu3O4 Eu2O3 EuO(OH) Eu2O2S |
Gd2O3 | Tb | Dy2O3 | Ho2O3 Ho2O2S |
Er2O3 | Tm2O3 | YbO Yb2O3 |
Lu2O2S Lu2O3 LuO(OH) |
||
| Ac2O3 | UO2 UO3 U3O8 |
PaO PaO2 Pa2O5 PaOS |
ThO2 | NpO NpO2 Np2O5 Np3O8 NpO3 |
PuO Pu2O3 PuO2 PuO3 PuO2F2 |
AmO2 | Cm2O3 CmO2 |
Bk2O3 | Cf2O3 | Es | Fm | Md | No | Lr |
Окись бария
- Окись бария
-
Оксид бария — одно из бинарных неорганических веществ, имеющее формулу BaO. Является основным оксидом.
Оксид бария Общие Систематическое наименование Оксид бария Традиционные названия Окись бария Химическая формула BaO Эмпирическая формула BaO Молярная масса 153,3394 г/моль Физические свойства Плотность вещества 5,72 (20°C)[1] г/см³ Состояние (ст. усл.) твёрдое Термические свойства Температура плавления 1920 °C Температура кипения 2000 °C Энтальпия (ст. усл.) -558,1 кДж/моль Классификация номер CAS 1304-28-5 Содержание
- 1 Описание
- 2 Получение
- 3 Химические свойства
- 4 Применение
- 5 Примечания
Описание
Оксид бария при стандартных условиях представляет собой бесцветные кристаллы с кубической решёткой [2]. Из-за высокой химической активности рекомендуется применять меры предосторожности.
Получение
1. Взаимодействие металлического бария с кислородом:
В этом случае наряду с оксидом бария образуется пероксид бария:
2. Разложение карбоната бария при нагревании:
Химические свойства
1. Энергичное взаимодействие с водой с образованием щёлочи и выделением тепла:
2. Взаимодействие с кислотными оксидами с образованием соли:
3. Взаимодействие с кислотами с образованием соли и воды:
4. Взаимодействие с кислородом при температуре около 600°C с образованием пероксида:
5. Восстановление до металла при нагревании с магнием, цинком, алюминием и кремнием [3].
Применение
Оксид бария применяется для покрытия катодов, в экранно-лучевых трубках, для производства некоторых видов стекла, например , оптического. В некоторых реакциях используется как катализатор.
Примечания
- ↑ Оксид бария на XuMuK.Ru
- ↑ Описание оксида бария на XuMuK.Ru
- ↑ Фрумина Н.С., Горюнова Н.Н., Еременко С.Н. Аналитическая химия бария — Москва: Наука, 1977. — 200 с
Wikimedia Foundation.
2010.
Полезное
Смотреть что такое «Окись бария» в других словарях:
-
окись бария — baritas statusas T sritis chemija atitikmenys: angl. baryta; calcined baryta rus. барит; окись бария ryšiai: sinonimas – bario oksidas … Chemijos terminų aiškinamasis žodynas
-
бария окись — bario oksidas statusas T sritis chemija formulė BaO atitikmenys: angl. baryta; barium oxide; barium protoxide rus. бария окись; бария оксид ryšiai: sinonimas – baritas … Chemijos terminų aiškinamasis žodynas
-
бария оксид — bario oksidas statusas T sritis chemija formulė BaO atitikmenys: angl. baryta; barium oxide; barium protoxide rus. бария окись; бария оксид ryšiai: sinonimas – baritas … Chemijos terminų aiškinamasis žodynas
-
Окись этилена — Окись этилена … Википедия
-
окись кальция — Регулятор кислотности пищевого продукта, получаемый обжигом извести в печах при температурах от 900 °С до 1200 °С, содержащий основного вещества СаО не менее 95,0 % по остатку от сжигания, фторидов не более 50 мг/кг, бария не более 300… … Справочник технического переводчика
-
Окись — Оксид (окисел, окись) соединение химического элемента с кислородом, в котором сам кислород связан только с менее электроотрицательным элементом. Химический элемент кислород по электроотрицательности второй после фтора, поэтому к оксидам… … Википедия
-
Оксид бария — Оксид бария одно из бинарных неорганических веществ, имеющее химическую формулу BaO. Является основным оксидом. Оксид бария Общие Систематическое наименование Оксид бария Традиционные названия Окись бария Химическая формула BaO … Википедия
-
Бариева окись — и гидрат окиси бария см. Барий и его соединения (1 и 2) … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
-
Барий — I (хим. обозн. Ва, атомный вес 137) принадлежит к группе щелочноземельных металлов и по своим свойствам в особенности близок к кальцию и стронцию. Металлическая природа его доказана Берцелиусом, получившим амальгаму бария, из которой Дэви в 1808… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
-
Кислород — (нем. Sauerstoff, франц. oxygène, англ. oxygen) нормальная и весьма важная составная часть воздуха, в обычных условиях температуры и давления бесцветный газ, без вкуса и запаха (история открытия К. см. Воздух). В виде соединений К. распространен… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Физические свойства
Оксид бария BaO — бинарное неорганическое вещество. Белый, тугоплавкий, термически устойчивый, летучий при высоких температурах. Энергично реагирует с водой (образуется щелочной раствор). Проявляет основные свойства.
Относительная молекулярная масса Mr = 153,33; относительная плотность для тв. и ж. состояния d = 5,72; tпл ≈ 2020º C.
Способ получения
1. Оксид бария получается при разложении карбоната бария при температуре 1000 — 1450º C. В результате разложения образуется оксид бария и углекислый газ:
BaCO3 = BaO + CO2
2. В результате разложения нитрата бария при температуре 620 — 670º С образуется оксид бария, оксид азота (IV) и кислород:
2Ba(NO3)2 = 2BaO + 4NO2 + O2
3. Оксид бария можно получить сжиганием бария в в кислороде при температуре до 500º С, в результате реакции образуется оксид бария:
2Ba + O2 = 2BaO,
4. Пероксид бария разлагается при температуре выше 790º С с образованием оксида бария и кислорода:
2BaO2 = 2BaO + O2
5. Карбонат бария вступает в реакцию с углеродом (коксом) и образует оксид бария и угарный газ при выше 1000º С:
BaCO3 + C = BaO + 2CO
Химические свойства
1. Оксид бария реагирует с простыми веществами:
1.1. Оксид бария реагирует с кислородом при температуре до 500º С и образует пероксид бария:
2BaO + O2 = 2BaO2
1.2. При 1100 — 1200º С оксид бария вступает в реакцию с алюминием и образует барий и алюминат бария:
4BaO + 2Al = 3Ba + Ba(AlO2)2
1.3. Оксид бария вступает во взаимодействие с кремнием при 1200º С с образованием силиката бария и бария:
3BaO + Si = BaSiO3 + 2Ba
2. Оксид бария взаимодействует со сложными веществами:
2.1. Оксид бария взаимодействует с кислотами:
Оксид бария с разбавленной соляной кислотой образует хлорид бария и воду:
BaO + 2HCl = BaCl2 + H2O
2.2. Оксид бария реагирует с кислотными оксидами.
Оксид бария при комнатной температуре реагирует с углекислым газом с образованием карбоната бария:
BaO + CO2 = BaCO3
2.3. Оксид бария взаимодействует с водой при комнатной температуре, образуя гидроксид бария:
BaO + H2O = Ba(OH)2
Содержание
- Получение
- Применение
- Физиологическое значение
Оксид бария — бинарное неорганическое химическое соединение бария с кислородом, имеющее химическую формулу BaO. Является основным оксидом. При стандартных условиях представляет собой бесцветные кристаллы с кубической решёткой. Ядовит.
| Оксид бария | |
|---|---|
| Общие | |
| Систематическое наименование |
Оксид бария |
| Традиционные названия | Оксид бария, окись бария; безводный барит |
| Хим. формула | BaO |
| Рац. формула | BaO |
| Физические свойства | |
| Состояние | твёрдое |
| Молярная масса | 153,3394 г/моль |
| Плотность | 5,72 (20 °C) |
| Термические свойства | |
| Температура | |
| • плавления | 1920 °C |
| • кипения | 2000 °C |
| Энтальпия | |
| • образования | -558,1 кДж/моль |
| Классификация | |
| Рег. номер CAS | 1304-28-5 |
| PubChem | 62392 |
| Рег. номер EINECS | 215-127-9 |
| SMILES |
O=[Ba] |
| InChI |
1S/Ba.O QVQLCTNNEUAWMS-UHFFFAOYSA-N |
| RTECS | CQ9800000 |
| ChemSpider | 56180 |
| Безопасность | |
| Предельная концентрация | 0,5 мг/м³ |
| ЛД50 | 146 мг/кг (крыса, внутрижелудочно) |
| Токсичность | Класс опасности 2 |
| NFPA 704 |
Получение
1. Взаимодействие металлического бария с кислородом:
2. Разложение карбоната бария при нагревании:
5. Восстановление до металла при нагревании с магнием, цинком, алюминием и кремнием.
Применение
Поскольку работа выхода электронов из оксида бария низка, то при невысокой стоимости и технологичности он давно и широко применяется как один из компонентов покрытия катодов различных электровакуумных приборов, телевизионных, осциллографических трубках и др. Например, смесь для катодов «Radio Mix No. 3» от фирмы «J. T. Baker Chemical Co.» состоит на 57,3 % из карбоната бария, который при нагревании в вакууме разлагается до оксида бария.
Также используется для производства некоторых видов стекла, например, оптического.
В некоторых реакциях окись бария используется как катализатор.
Яркость поверхности, покрытой оксидом бария или оксидом магния, принимается за единицу при измерениях коэффициента яркости других поверхностей.
Физиологическое значение
Вещество токсично. ПДК 0,7 мг/л. При попадании на кожу и слизистые оболочки глаз в большом количестве оксид бария может вызывать химические ожоги; пожаро- и взрывобезопасен.
Имеются данные, что оксид бария может обладать щелочными свойствами.
ЛД50 для крыс при внутрижелудочном введении составляет 146 мг/кг.
Описание соединения
Вещество представляет собой соединение бария (латинское название — Barium) с кислородом. Металл выступает элементом таблицы Менделеева с порядковым номером 56. Структурная формула оксида бария — BaO. Соединение представляет собой светлое неорганическое вещество. Его открыл в 1774 году шведский химик-фармацевт Карл Вильгельм Шееле.
Барий был обнаружен в составе земной коры в XVIII веке. Первые упоминания о щёлочноземельном металле связаны с его кислородным соединением — окисью. Барий химически активен. Чтобы получить его в чистом виде, нужно провести несколько реакций с катализатором. Поскольку в природе элемент чаще можно найти в его сульфате (барите) и карбонате (витерите), именно из них сначала получают оксид элемента, из которого затем осаждают необходимый металл.
BaO — основной оксид химического элемента. В стандартных условиях (агрегатном состоянии) он представлен порошком или кристаллами белого или серебристого оттенка, которые не имеют запаха и вкуса. Вещество характеризуется кубическим типом кристаллической решётки. Оксид бария в технической модификации может обладать сероватым оттенком. Такой окрас обусловлен углём, который остался в небольшом количестве при получении соединения. Окись также называют безводным баритом.
Основные физические характеристики оксида бария:
- плотность при 20 °C — 5,72 г/см3;
- температура плавления — 2000 °C;
- температура кипения — 1920 °C;
- молярная и молекулярная масса — 153,34 г/моль.
Оксиду свойственна высокая теплопроводность — 4,8−7,8 Вт/(мК)(80−1100К). Это довольно пластичный металл, который легко поддаётся ковке. При температуре 200 °C показатель растворимости вещества в воде равен 1,5 г/100 г.
Химические свойства
Любые соединения с барием токсичны, за исключением его сульфата. Поэтому при работе с окисью металла следует соблюдать меры безопасности.
Вещество не растворяется в воде: оксид бария реагирует с ней. Взаимодействуя с H2O, он даёт в результате щелочной раствор плюс тепло. Уравнение соединения показывает, что оно является солеобразующим, соответственно, при взаимодействии безводного барита с кислотными оксидами и кислотами получаются соли.
При нагревании до 600 °C окись бария с кислородом образуют пероксид. В дальнейшем полученное вещество нагревают до температуры 700 °C, чтобы выделить чистый металл и оксид. Восстановление до необходимого элемента происходит путём прокаливания с магнием, алюминием, кремнием и цинком, которые забирают выделяемый кислород.
Также необходимо знать, какой вид химической связи в оксиде бария. Поскольку в соединении содержатся металл и неметалл, связь между их атомами ионная.
Способы получения
Безводный барит можно получить несколькими методами. Способ выбирают в зависимости от поставленной цели и после определения объёма получаемого соединения.
В лабораторных и промышленных условиях используют любые методы:
- Кальцинирование. Предварительно осаждённый нитрат бария прокаливают, а в результате реакции образуются оксид металла, диоксид азота и чистый кислород.
- Сжигание. При этой реакции металл сжигают в кислороде. Катализатором служит температура 500−6000°C, однако в этом случае возможно образование пероксида бария — BaO2. Важно правильно записать его формулу, чтобы не перепутать с другими оксидами металла. При дальнейшем нагревании соединение распадается на окись вещества и свободный кислород.
- Реакция термического разложения. Для получения необходимого оксида используют гидроксид бария. При температуре 780−800°C образуется BaO и вода.
Также может применяться карбонат бария, который в термических условиях разлагается на оксид и углекислый газ. Чтобы получить более чистый конечный продукт, из вещества удаляют лишний диоксид углерода.
Сфера применения
Поскольку выход BaO низок, он часто применяется в работах по покрытию катодов, которые входят в вакуумные приборы, на деталях телевизионных устройств и осциллографических трубок. Большой спрос также обусловлен низкой стоимостью материала.
Вещество активно используют и в других сферах:
- Соединение бария отличается мощной яркостью при покрытии им поверхностей иных материалов. Окись металла часто применяют в пиротехнике и добавляют в состав эмалей и глазурей для декоративной облицовки, чтобы получить зелёный цвет.
- Оксид нередко используют в качестве катализатора для проведения химических реакций. Обычно оно необходимо для осаждения чистого бария, а также получения пероксида и гидроксида.
- Вещество применяется в сочетании с редкоземельными металлами и окисью меди при производстве керамики, используемой при низких температурах.
- Соединение может выступать одним из главных элементов в составе стёкол специфичных направлений: BaO позволяет производить непроницаемый материал для рентгеновских установок.
Оксид бария выступает в роли электролитного компонента в составе фторионных аккумуляторных батарей. Он используется в отрасли атомно-водородной и ядерной техники. Материалом покрывают урановые стержни. Он незаменим при производстве оптических приборов (призм, линз) и антикоррозийных поверхностей. Кроме того, вещество применяют при разработке и создании оборудования в медицинской сфере.
Влияние на человеческий организм
Барий не относится к жизненно важным микроэлементам. Его соединения могут быть опасны для здоровья и жизни человека, поэтому перед использованием окиси бария необходимо узнать о соответствующих мерах безопасности при работе с веществом.
Оксид металла считается высокотоксичным соединением. При отравлениях этим веществом у человека могут проявляться следующие симптомы:
- повышенное слюнотечение;
- чувство жжения в полости рта;
- дискомфорт в животе.
Интоксикация иногда сопровождается тошнотой или рвотой. Кроме того, пострадавшего могут беспокоить выраженные болезненные ощущения в области желудка или острые колики. Тяжёлое отравление может привести к летальному исходу, который обычно наступает в течение суток. Смертельная доза вещества для человека составляет около 0,8 г.
Меры безопасности
Оксид металла нельзя транспортировать рядом с пищевыми продуктами, косметическими средствами, кормами для животных и разными водными организмами. На фасовке со средством обязательно присутствует один из символов:
- Xn — раздражающее воздействие отмеченного соединения;
- R20/22 — опасность при вдохе или проглатывании оксида;
- S17 — хранение средства на максимальном расстоянии от горюче-смазочных материалов;
- S28 — незамедлительное промывание водой кожного покрова при случайном попадании на него вещества.
Средство с барием выпускают в упаковках по 1, 20−25, 100, 500 и 1000 кг. Фасовкой служат стеклянные банки, полипропиленовые мешки или полиэтиленовые пакеты. На любой упаковке обязательно указывают класс степени опасности 5:1. На некоторых фасовках может присутствовать значение вторичной опасности — 6:1.
Опасное вещество требует особых условий хранения. Оксид бария нужно держать подальше от легко возгораемых средств, восстанавливающих агентов, металлов в порошкообразном виде. Рядом с веществом не должны находиться продукты питания и корма для сельскохозяйственных животных.
Окись бария была изучена со многих сторон. Но учёные стараются найти ему и другое применение. Возможно, что в скором будущем появятся новые технологии, которые будут связаны с этим веществом.
Оксид бария, характеристика, свойства и получение, химические реакции.
Оксид бария – неорганическое вещество, имеет химическую формулу BaO.
Краткая характеристика оксида бария
Физические свойства оксида бария
Получение оксида бария
Химические свойства оксида бария
Химические реакции оксида бария
Применение и использование оксида бария
Краткая характеристика оксида бария:
Оксид бария – неорганическое вещество, не имеющее цвета.
Так как валентность бария равна двум, то оксид бария содержит один атом кислорода и один атом бария.
Химическая формула оксида бария BaO.
В воде не растворяется, а реагирует с ней.
Физические свойства оксида бария:
| Наименование параметра: | Значение: |
| Химическая формула | BaO |
| Синонимы и названия иностранном языке | barium oxide (англ.) |
| Тип вещества | неорганическое |
| Внешний вид | бесцветные кубические кристаллы |
| Цвет | без цвета |
| Вкус | —* |
| Запах | — |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | твердое вещество |
| Плотность (состояние вещества – твердое вещество, при 20 °C), кг/м3 | 5720 |
| Плотность (состояние вещества – твердое вещество, при 20 °C), г/см3 | 5,72 |
| Температура кипения, °C | 2000 |
| Температура плавления, °C | 1920 |
| Молярная масса, г/моль | 153,3394 |
* Примечание:
— нет данных.
Получение оксида бария:
Оксид бария получают в результате следующих химических реакций:
- 1. сжиганием бария в кислороде:
2Ba + О2 → 2BaО.
- 2. путем термического разложения гидроксида бария:
Ba(OH)2 → BaO + H2О (t = 780-800 oC).
- 3. путем термического разложения карбоната бария:
BaCO3 → BaO + CO2 (t = 1000-1450 oC).
- 4. путем термического разложения нитрата бария:
2Ba(NO3)2 → 2BaO + 4NO2 + O2 (t = 620-670 oC).
Химические свойства оксида бария. Химические реакции оксида бария:
Оксид бария относится к основным оксидам.
Химические свойства оксида бария аналогичны свойствам основных оксидов других металлов. Поэтому для него характерны следующие химические реакции:
1. реакция оксида бария с бериллием:
BaO + Be → Ba + BeO (t = 270 oC).
В результате реакции образуется барий и оксид бериллия. Таким образом, барий восстанавливается из оксида бария бериллием при температуре 270 oC.
2. реакция оксида бария с алюминием:
3BaO + 2Al → 3Ba + Al2O3 (t = 1200 oC),
2Al + 4BaO → Ba(AlO2)2 + 3Ba (t = 1100-1200 oC),
2Al + 4BaO → BaAl2O4 + 3Ba (t = 1100-1200 oC).
В результате реакции в первом случае образуется барий и оксид алюминия. Таким образом, барий восстанавливается из оксида бария алюминием при температуре 1200 oC.
Во втором и третьем случаях образуется барий и соль – алюминат бария.
3. реакция оксида бария с кремнием:
3BaO + Si → 2Ba + BaSiO3 (t = 1200 oC).
В результате реакции образуется соль – силикат бария и барий.
4. реакция оксида бария с кислородом:
BaO + O2 → 2BaO2 (t = 500 oC).
В результате реакции образуется пероксид бария.
5. реакция оксида бария с водой:
BaO + H2O → Ba(OH)2.
В результате реакции образуется гидроксид бария.
6. реакция оксида бария с оксидом цинка:
BaO + ZnO → BaZnO2 (t = 1100 oC).
В результате реакции образуется cоль – цинкат бария.
7. реакция оксида бария с оксидом титана:
BaO + TiO2 → BaTiO3.
В результате реакции образуется соль – метатитанат бария.
8. реакция оксида бария с оксидом кадмия:
BaO + CdO → BaCdO2 (t = 1100 oC).
В результате реакции образуется оксид бария-кадмия.
9. реакция оксида бария с оксидом меди:
BaO + Cu2O → BaCu2O2 (t = 500-600 oC).
В результате реакции образуется оксид бария-меди.
10. реакция оксида бария с оксидом германия:
BaO + GeO2 → BaGeO3 (t = 1200 oC).
В результате реакции образуется соль – метагерманат бария.
11. реакция оксида бария с оксидом гафния:
BaO + HfO2 → BaHfO3 (t = 1800-2200 oC).
В результате реакции образуется оксид гафния-бария.
12. реакция оксида бария с оксидом марганца:
BaO + MnO → BaMnO2 (t = 1800 oC),
8BaO + MnO2 → Ba8MnO10 (t = 800 oC).
В результате реакции образуется в первом случае оксид бария-марганца, во втором – оксид марганца-октабария.
13. реакция оксида бария с оксидом никеля:
BaO + NiO → BaNiO2 (t = 1200 oC).
В результате реакции образуется оксид никеля-бария.
14. реакция оксида бария с оксидом циркония:
BaO + ZrO2 → BaZrO3 (t = 1800-2200 oC).
В результате реакции образуется оксид циркония-бария (цирконат бария).
15. реакция оксида бария с оксидом олова:
BaO + SnO → BaSnO2 (t = 1000 oC).
В результате реакции образуется оксид олова-бария.
16. реакция оксида бария с оксидом ванадия:
2BaО + VО2 → Ba2VО4 (t = 1500-1700 oC).
В результате реакции образуется соль – тетраоксованадат бария.
17. реакция оксида бария с оксидом углерода:
BaO + CO2 → BaCO3.
В результате реакции образуется соль – карбонат бария.
18. реакция оксида бария с оксидом серы:
BaO + SO3 → BaSO4.
В результате реакции образуется соль – сульфат бария.
19. реакция оксида бария с плавиковой кислотой:
BaO + 2HF → BaF2 + H2O.
В результате химической реакции получается соль – фторид бария и вода.
20. реакция оксида бария с азотной кислотой:
BaO + 2HNO3 → 2Ba(NO3)2 + H2O.
В результате химической реакции получается соль – нитрат бария и вода.
21. реакция оксида бария с ортофосфорной кислотой:
3BaO + 2H3PO4 → Ba3(PO4)2 + 3H2O.
В результате химической реакции получается соль – ортофосфат бария и вода.
Аналогично проходят реакции оксида бария и с другими кислотами.
22. реакция оксида бария с бромистым водородом (бромоводородом):
BaO + 2HBr → BaBr2 + H2O.
В результате химической реакции получается соль – бромид бария и вода.
23. реакция оксида бария с йодоводородом:
BaO + 2HI → BaI2 + H2O.
В результате химической реакции получается соль – йодид бария и вода.
Применение и использование оксида бария:
Оксид бария применяется в качестве покрытия различных приборов, а также наполнителя, компонента и катализатора в химической промышленности и в производстве стекла.
Примечание: © Фото //www.pexels.com, //pixabay.com
оксид бария реагирует кислота 1 2 3 4 5 вода
уравнение реакций соединения масса взаимодействие оксида бария
реакции с оксидом бария
Коэффициент востребованности
6 441
| Оксид бария | |
|---|---|
| Систематическое наименование |
Оксид бария |
| Традиционные названия | Окись бария |
| Хим. формула | BaO |
| Рац. формула | BaO |
| Состояние | твёрдое |
| Молярная масса | 153,3394 г/моль |
| Плотность | 5,72 (20 °C) |
| Температура | |
| • плавления | 1920 °C |
| • кипения | 2000 °C |
| Энтальпия | |
| • образования | -558,1 кДж/моль |
| Рег. номер CAS | 1304-28-5 |
| PubChem | 62392 |
| Рег. номер EINECS | 215-127-9 |
| SMILES |
O=[Ba] |
| InChI |
1S/Ba.O QVQLCTNNEUAWMS-UHFFFAOYSA-N |
| RTECS | CQ9800000 |
| ChemSpider | 56180 |
| Токсичность | Ядовит |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
Получение
1. Взаимодействие металлического бария с кислородом:
2Ba + O2 ⟶ 2BaO
В этом случае наряду с оксидом бария образуется пероксид бария:
Ba + O2 ⟶ BaO2
2. Разложение карбоната бария при нагревании:
BaCO3 ⟶ BaO + CO2↑
3. Разложение нитрата бария при нагревании. 2Ba(NO3)2 = 2BaO + 4NO2 + O2
Химические свойства
1. Энергичное взаимодействие с водой с образованием щёлочи и выделением тепла:
BaO + H2O ⟶ Ba(OH)2
2. Взаимодействие с кислотными оксидами с образованием соли:
BaO + CO2 ⟶ BaCO3
BaO + SO3 ⟶ BaSO4↓
3. Взаимодействие с кислотами с образованием соли и воды:
BaO + 2HCl ⟶ BaCl2 + H2O
BaO + H2SO4 ⟶ BaSO4↓ + H2O
4. Взаимодействие с кислородом при температуре около 600 °C с образованием пероксида:
2BaO + O2 ⟶ 2BaO2
5. Восстановление до металла при нагревании с магнием, цинком, алюминием и кремнием.
Применение
Поскольку работа выхода оксида бария низка, то при невысокой стоимости и технологичности он давно и широко применяется для покрытия катодов различных электронно-вакуумных приборов, телевизионных, осциллографических трубках и др.
Также используется для производства некоторых видов стекла, например, оптического.
В некоторых реакциях используется как катализатор.
Яркость поверхности, покрытой оксидом бария или оксидом магния, принимается за единицу при измерениях коэффициента яркости других поверхностей.