Содержание
- Физические свойства
- Химические свойства
- Получение
- Лабораторные методы
- Промышленное производство
- Применение
- Опасность
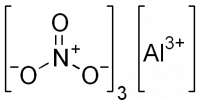
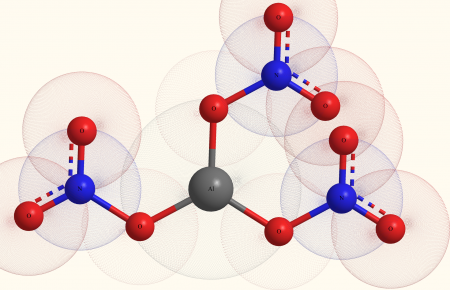
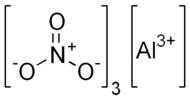
Нитрат алюминия, азотнокислый алюминий — Al(NO3)3, неорганическое соединение, алюминиевая соль азотной кислоты.
| Нитрат алюминия | |
|---|---|
| Общие | |
| Систематическое наименование |
Нитрат алюминия |
| Традиционные названия | Азотнокислый алюминий; нитрат алюминия(+3), тринитрат алюминия, алюминия (III) нитрат |
| Хим. формула | Al(NO3)3 |
| Рац. формула | Al(NO3)3 |
| Физические свойства | |
| Состояние | твёрдое |
| Молярная масса | 212,996 г/моль |
| Плотность | 1,89 |
| Термические свойства | |
| Температура | |
| • плавления | 66 °C (с разл.); нонагидрат: 73,5 |
| Энтальпия | |
| • образования | − 927 кДж/моль; нонагидрат: − 3757; гексагидрат: − 2871 кДж/моль |
| Химические свойства | |
| Растворимость | |
| • в воде | при 25 °C: 63,7 г/100 мл |
| • в воде | нонагидрат при 20 °C: 73,9 |
| • в в метаноле | при 35 °C: 14,45 |
| • в в этаноле | при 35 °C: 8,63 |
| • в в этиленгликоле | при 35 °C: 18,32 |
| Структура | |
| Кристаллическая структура | моноклинная |
| Классификация | |
| Рег. номер CAS | 13473-90-0 7784-27-2 (нонагидрат) |
| PubChem | 16713320 |
| Рег. номер EINECS | 236-751-8 |
| SMILES |
[Al+3].O=[N+]([O-])[O-].[O-][N+]([O-])=O.[O-][N+]([O-])=O |
| InChI |
1S/Al.3NO3/c;3*2-1(3)4/q+3;3*-1 JLDSOYXADOWAKB-UHFFFAOYSA-N |
| RTECS | BD1040000 BD1050000 (нонагидрат) |
| ChemSpider | 24267 |
| Безопасность | |
| ЛД50 | (крысы, перорально) 4280 мг/кг |
| Токсичность | Низкая |
| NFPA 704 |
Помимо собственно безводного нитрата, у алюминия существуют и основные нитраты: AlOH(NO3)2 и Al(OH)2NO3, а также ряд гидратированных солей Al(NO3)3•xH2O (х = 4, 6, 8, 9), среди которых наиболее стабилен нонагидрат: Al(NO3)3•9H2O.
Физические свойства
Безводный нитрат алюминия представляет собой белое или бесцветное кристаллическое, чрезвычайно гигроскопичное вещество, дымящее на воздухе. Хорошо растворим в холодной воде (63,7 % при 25 °C) и полярных органических растворителях. Температура плавления 66 °C (с разложением), в вакууме возгоняется при 50 °C.
Нонагидрат Al(NO3)3•9H2O — белые кристаллы, расплывающееся на воздухе, с моноклинной структурой (a=1,086 нм, b=0,959 нм, c=1,383 нм, β=95,15°, z=4, пространственная группа P21/a). При нагревании чуть выше температуры плавления (73,6 °C) теряет сперва одну, а затем ещё две молекулы воды.
Плотность водного раствора нитрата алюминия при 18 °C:
| 1 % | 2 % | 4 % | 6 % | 8 % | 10 % | 12 % | 14 % | |
|---|---|---|---|---|---|---|---|---|
| Плотность, г/л | 1006,5 | 1014,4 | 1030,5 | 1046,9 | 1063,8 | 1081,1 | 1098,9 | 1117,1 |
| 16 % | 18 % | 20 % | 24 % | 28 % | 30 % | 32 % | — | |
| 1135,7 | 1154,9 | 1174,5 | 1215,3 | 1258,2 | 1280,5 | 1303,6 | — |
Химические свойства
- При растворении в воде подвергается гидролизу:
- Водные растворы нитрата алюминия имеют pH от 2,5 до 3,7.
- При нагревании гидролиз можно провести полностью:
- Вступает в реакцию со щелочами:
- Реакция с концентрированным водным раствором аммиака может идти по двум направлениям.
- На холоде:
- При нагревании:
- При нагревании разлагается :
- Нонагидрат при сильном нагревании (135 °C) сперва образует основную соль Al(OH)2NO3•1,5H2O, а при более высокой температуре (200 °C) разлагается до аморфного оксида алюминия.
- Нитрат алюминия является сильным окислителем — его безводная форма со взрывом реагирует со многими органическими растворителями (например: с диэтиловым эфиром и бензолом).
Получение
Лабораторные методы
В лаборатории водный раствор нитрата алюминия получают растворением алюминия в разбавленной азотной кислоте:
Альтернативный метод заключается во взаимодействии гидроксида алюминия с азотной кислотой:
Наконец, искомую соль можно получить обменной реакцией сульфата алюминия с нитратом бария или свинца:
Из водного раствора посредством кристаллизации выделяют нонагидрат нитрата алюминия. Кристаллогидраты с меньшим количеством воды получают из водных растворов азотной кислоты.
Безводный нитрат алюминия можно получить реакцией кристаллогидрата с избытком оксидом азота (V) (реакция (1)) или безводного хлорида алюминия с нитратом хлора (реакция (2)):
Промышленное производство
В промышленности безводный нитрат алюминия получают взаимодействием оксида или гидроксида алюминия с оксидом азота (V):
В случае использования бромида алюминия в качестве исходного сырья для синтеза, реакция идёт в две стадии:
Применение
Соединение используется в текстильной промышленности как протрава при крашении тканей, для дубления кожи, в производстве нитей накаливания, в качестве катализатора при очистке нефти, антикоррозионного агента; в производстве изоляционных бумаг, нагревательных элементах, антиперспирантов; в ядерной физике.
Опасность
ЛД50 (крысы, перорально) = 4,28 г/кг.
| Нитрат алюминия | |
|---|---|
  |
|
 |
|
| Общие | |
| Систематическое наименование |
Нитрат алюминия |
| Традиционные названия | Азотнокислый алюминий; нитрат алюминия(+3), тринитрат алюминия, алюминия (III) нитрат |
| Хим. формула | Al(NO3)3 |
| Рац. формула | Al(NO3)3 |
| Физические свойства | |
| Состояние | твёрдое |
| Молярная масса | 212,996 г/моль |
| Плотность | 1,89[1] |
| Термические свойства | |
| Температура | |
| • плавления | +66 °C (с разл.)[1]; нонагидрат: 73,5[1] |
| • разложения | +150-200 °C |
| Энтальпия | |
| • образования |
− 927 кДж/моль; нонагидрат: − 3757[2]; гексагидрат: − 2871[3] кДж/моль |
| Химические свойства | |
| Растворимость | |
| • в воде | при 25 °C: 63,7 г/100 мл |
| • в воде | нонагидрат при 20 °C: 73,9[4] |
| • в в метаноле | при 35 °C: 14,45[5] |
| • в в этаноле | при 35 °C: 8,63[5] |
| • в в этиленгликоле | при 35 °C: 18,32[5] |
| Структура | |
| Кристаллическая структура | моноклинная |
| Классификация | |
| Рег. номер CAS |
13473-90-0 7784-27-2 (нонагидрат) |
| SMILES |
[Al+3].O=[N+]([O-])[O-].[O-][N+]([O-])=O.[O-][N+]([O-])=O |
| RTECS |
BD1040000 BD1050000 (нонагидрат) |
| Безопасность | |
| ЛД50 | (крысы, перорально) 4280 мг/кг |
| Токсичность | Низкая |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
Нитра́т алюми́ния, азотнокислый алюминий — Al(NO3)3, неорганическое соединение, алюминиевая соль азотной кислоты.
Помимо собственно безводного нитрата, у алюминия существуют и основные нитраты: AlOH(NO3)2 и Al(OH)2NO3, а также ряд гидратированных солей Al(NO3)3•xH2O (х = 4, 6, 8, 9), среди которых наиболее стабилен нонагидрат: Al(NO3)3•9H2O.
Физические свойства
Безводный нитрат алюминия представляет собой белое или бесцветное кристаллическое, чрезвычайно гигроскопичное вещество, дымящее на воздухе[2][6]. Хорошо растворим в холодной воде (63,7 % при 25 °C) и полярных органических растворителях[6]. Температура плавления 66 °C (с разложением), в вакууме возгоняется при 50 °C. Разлагается в горячей воде[2].
Нонагидрат Al(NO3)3•9H2O — белые кристаллы, расплывающееся на воздухе, с моноклинной структурой (a=1,086 нм, b=0,959 нм, c=1,383 нм, β=95,15°, z=4, пространственная группа P21/a). При нагревании чуть выше температуры плавления (73,6 °C) теряет сперва одну, а затем ещё две молекулы воды[2].
Плотность водного раствора нитрата алюминия при 18 °C[7]:
| 1 % | 2 % | 4 % | 6 % | 8 % | 10 % | 12 % | 14 % | |
|---|---|---|---|---|---|---|---|---|
| Плотность, г/л | 1006,5 | 1014,4 | 1030,5 | 1046,9 | 1063,8 | 1081,1 | 1098,9 | 1117,1 |
| 16 % | 18 % | 20 % | 24 % | 28 % | 30 % | 32 % | — | |
| 1135,7 | 1154,9 | 1174,5 | 1215,3 | 1258,2 | 1280,5 | 1303,6 | — |
Химические свойства
- При растворении в воде подвергается гидролизу[8]:
- [math]displaystyle{ mathsf{Al(NO_3)_3+4H_2Oleftrightarrows[Al(H_2O)_4]^{3+}+3NO_3^-} }[/math]
- [math]displaystyle{ mathsf{[Al(H_2O)_4]^{3+}+H_2Oleftrightarrows[Al(H_2O)_3(OH)]^{2+}+H_3O^+} }[/math]
- Водные растворы нитрата алюминия имеют pH от 2,5 до 3,7[9].
- При нагревании гидролиз можно провести полностью[8]:
- [math]displaystyle{ mathsf{Al(NO_3)_3+3H_2O=Al(OH)_3!downarrow!+3HNO_3!uparrow} }[/math]
- Вступает в реакцию со щелочами:
- [math]displaystyle{ mathsf{Al(NO_3)_3+3NaOH=Al(OH)_3!downarrow!+3NaNO_3} }[/math]
- [math]displaystyle{ mathsf{Al(NO_3)_3+4NaOH=Na[Al(OH)_4]+3NaNO_3} }[/math]
- Реакция с концентрированным водным раствором аммиака может идти по двум направлениям[8].
- На холоде:
- [math]displaystyle{ mathsf{Al(NO_3)_3+3NH_3+3H_2O=Al(OH)_3!downarrow!+3NH_4NO_3} }[/math]
- При нагревании:
- [math]displaystyle{ mathsf{Al(NO_3)_3+3NH_3+3H_2O=AlO(OH)!downarrow!+3NH_4NO_3+H_2O} }[/math]
- При нагревании разлагается [8]:
- [math]displaystyle{ mathsf{4Al(NO_3)_3=2Al_2O_3+12NO_2!uparrow+3O_2!uparrow} }[/math]
- Нонагидрат при сильном нагревании (135 °C) сперва образует основную соль Al(OH)2NO3•1,5H2O, а при более высокой температуре (200 °C) разлагается до аморфного оксида алюминия[10].
- Нитрат алюминия является сильным окислителем — его безводная форма со взрывом реагирует со многими органическими растворителями (например: с диэтиловым эфиром и бензолом).
Получение
Лабораторные методы
В лаборатории водный раствор нитрата алюминия получают растворением алюминия в разбавленной азотной кислоте:
- [math]displaystyle{ mathsf{8Al+30HNO_3=8Al(NO_3)_3+3N_2O!uparrow+15H_2O} }[/math]
Альтернативный метод заключается во взаимодействии гидроксида алюминия с азотной кислотой:
- [math]displaystyle{ mathsf{Al(OH)_3+3HNO_3=Al(NO_3)_3+3H_2O} }[/math]
Наконец, искомую соль можно получить обменной реакцией сульфата алюминия с нитратом бария или свинца:
- [math]displaystyle{ mathsf{Al_2(SO_4)_3+3Ba(NO_3)_2=2Al(NO_3)_3+3BaSO_4!downarrow} }[/math]
Из водного раствора посредством кристаллизации выделяют нонагидрат нитрата алюминия. Кристаллогидраты с меньшим количеством воды получают из водных растворов азотной кислоты[10].
Безводный нитрат алюминия можно получить реакцией кристаллогидрата с избытком оксидом азота (V) (реакция (1)) или безводного хлорида алюминия с нитратом хлора (реакция (2))[10][11]:
- [math]displaystyle{ mathsf{Al(NO_3)_3cdot9H_2O+9N_2O_5longrightarrow Al(NO_3)_3+18HNO_3~~~~~~(1)} }[/math]
- [math]displaystyle{ mathsf{AlCl_3+3ClNO_3longrightarrow Al(NO_3)_3+3Cl_2~~~~~~(2)} }[/math]
Промышленное производство
В промышленности безводный нитрат алюминия получают взаимодействием оксида или гидроксида алюминия с оксидом азота (V)[8]:
- [math]displaystyle{ mathsf{Al_2O_3+3N_2O_5longrightarrow 2Al(NO_3)_3} }[/math]
- [math]displaystyle{ mathsf{Al(OH)_3+3N_2O_5longrightarrow Al(NO_3)_3+3HNO_3} }[/math]
В случае использования бромида алюминия в качестве исходного сырья для синтеза, реакция идёт в две стадии:
- [math]displaystyle{ mathsf{2AlBr_3+8N_2O_5=2[NO_2]^-[Al(NO_3)_4]^++3Br_2+6NO_2} }[/math]
- [math]displaystyle{ mathsf{2[NO_2]^-[Al(NO_3)_4]=2Al(NO_3)_3+4NO_2+O_2} }[/math]
Применение
Соединение используется в текстильной промышленности как протрава при крашении тканей, для дубления кожи, в производстве нитей накаливания, в качестве катализатора при очистке нефти, антикоррозионного агента; в производстве изоляционных бумаг, нагревательных элементах, антиперспирантов; в ядерной физике[12].
Опасность
ЛД50 (крысы, перорально) = 4,28 г/кг[13].
Примечания
- ↑ 1,0 1,1 1,2 Лидин Р.А., Андреева Л.Л., Молочко В.А. Глава 3. Физические свойства // Константы неорганических веществ: справочник / Под редакцией проф. Р.А.Лидина. — 2-е изд., перераб. и доп.. — М.: «Дрофа», 2006. — С. 76. — ISBN 5-7107-8085-5.
- ↑ 2,0 2,1 2,2 2,3
Алюминия нитрат // Химическая энциклопедия / Главный редактор И. Л. Кнунянц. — М.: «Советская энциклопедия», 1988. — Т. 1. — С. 212. - ↑ Лидин Р.А., Андреева Л.Л., Молочко В.А. Часть IV. Термодинамика. Глава 1. Энтальпия образования, энтропия и энергия Гиббса образования веществ // Константы неорганических веществ: справочник / Под редакцией проф. Р.А.Лидина. — 2-е изд., перераб. и доп.. — М.: «Дрофа», 2006. — С. 441. — ISBN 5-7107-8085-5.
- ↑ Лидин Р.А., Андреева Л.Л., Молочко В.А. Часть VI. Растворимость веществ в воде // Константы неорганических веществ: справочник / Под редакцией проф. Р.А.Лидина. — 2-е изд., перераб. и доп.. — М.: «Дрофа», 2006. — С. 618. — ISBN 5-7107-8085-5.
- ↑ 5,0 5,1 5,2 Perry D.L. , Phillips S.L. Handbook of Inorganic Compounds. — CRC Press, 1995. — P. 9. — ISBN 0-8493-8671-3.
- ↑ 6,0 6,1
Patnaik P. Handbook of inorganic chemical. — McGraw-Hill, 2003. — P. 9. — ISBN 0-07-049439-8. - ↑ Лидин Р.А., Андреева Л.Л., Молочко В.А. Часть VII. Плотность воды и водных растворов. Глава 3. Соли // Константы неорганических веществ: справочник / Под редакцией проф. Р.А.Лидина. — 2-е изд., перераб. и доп.. — М.: «Дрофа», 2006. — С. 641. — ISBN 5-7107-8085-5.
- ↑ 8,0 8,1 8,2 8,3 8,4 Лидин Р.А., Молочко В.А., Андреева Л.Л. Химические свойства неорганических веществ / Под редакцией проф. Р.А.Лидина. — 3-е изд.. — М.: «Химия», 2000. — С. 84. — ISBN 5-7245-1163-0.
- ↑ Тихонов В.Н. Аналитическая химия алюминия. — Серия «Аналитическая химия элементов». — М.: «Наука». — Т. 1971. — С. 16.
- ↑ 10,0 10,1 10,2 Downs A.J. Chemistry of aluminium, gallium, indium, and thallium. — First edition. — London: Chapman & Hall, 1993. — P. 153. — 526 p. — ISBN 0-7514-0103-X.
- ↑ Турова Н.Я. Неорганическая химия в таблицах. — М.: «Высший химический колледж РАН», 1997. — С. 66.
- ↑ Vincoli J. W. Aluminium nitrate // Risk Management for Hazardous Chemicals. — CRC Press, 1997. — 3136 p. — ISBN 1-56670-200-3.
- ↑ Gardner’s commercially important chemicals: synonyms, trade names, and properties / Edited by Milne G.W.A.. — New Jersey: John Wiley and Sons, 2005. — P. 22. — ISBN 0-471-73518-3.
Литература
- Downs A.J. Chemistry of aluminium, gallium, indium, and thallium. — First edition. — London: Chapman & Hall, 1993. — 526 p. — ISBN 0-7514-0103-X.
Ссылки
- Синтез нитрата алюминия на сайте Youtube. Архивная копия от 29 марта 2020 на Wayback Machine (англ.)
| Нитрат алюминия | |
|---|---|
  |
|
| Систематическое наименование |
Нитрат алюминия |
| Традиционные названия | Азотнокислый алюминий, нитрат алюминия, тринитрат алюминия, алюминия III нитрат |
| Хим. формула | Al(NO3)3 |
| Рац. формула | Al(NO3)3 |
| Состояние | твёрдое |
| Молярная масса | 212,996 г/моль |
| Плотность | 1,89 |
| Температура | |
| • плавления | 66 °C (с разл.); нонагидрат: 73,5 |
| Энтальпия | |
| • образования | − 927 кДж/моль; нонагидрат: − 3757; гексагидрат: − 2871 кДж/моль |
| Растворимость | |
| • в воде | при 25 °C: 63,7 г/100 мл |
| • в воде | нонагидрат при 20 °C: 73,9 |
| • в в метаноле | при 35 °C: 14,45 |
| • в в этаноле | при 35 °C: 8,63 |
| • в в этиленгликоле | при 35 °C: 18,32 |
| Кристаллическая структура | моноклинная |
| Рег. номер CAS | 13473-90-0 7784-27-2 (нонагидрат) |
| PubChem | 16713320 |
| Рег. номер EINECS | 236-751-8 |
| SMILES |
[Al+3].O=[N+]([O-])[O-].[O-][N+]([O-])=O.[O-][N+]([O-])=O |
| InChI |
1S/Al.3NO3/c;3*2-1(3)4/q+3;3*-1 JLDSOYXADOWAKB-UHFFFAOYSA-N |
| RTECS | BD1040000 BD1050000 (нонагидрат) |
| ChemSpider | 24267 |
| ЛД50 | (крысы, перорально) 4280 мг/кг |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
Нитрат алюминия, азотнокислый алюминий — Al(NO3)3, неорганическое соединение, алюминиевая соль азотной кислоты.
Помимо собственно безводного нитрата, у алюминия существуют и основные нитраты: AlOH(NO3)2 и Al(OH)2NO3, а также ряд гидратированных солей Al(NO3)3•xH2O (х = 4, 6, 8, 9), среди которых наиболее стабилен нонагидрат: Al(NO3)3•9H2O.
Содержание
- 1 Физические свойства
- 2 Химические свойства
- 3 Получение
- 3.1 Лабораторные методы
- 3.2 Промышленное производство
- 4 Применение
- 5 Опасность
Физические свойства
Безводный нитрат алюминия представляет собой белое или бесцветное кристаллическое, чрезвычайно гигроскопичное вещество, дымящее на воздухе. Хорошо растворим в холодной воде (63,7 % при 25 °C) и полярных органических растворителях. Температура плавления 66 °C (с разложением), в вакууме возгоняется при 50 °C.
Нонагидрат Al(NO3)3•9H2O — белые кристаллы, расплывающееся на воздухе, с моноклинной структурой (a=1,086 нм, b=0,959 нм, c=1,383 нм, β=95,15°, z=4, пространственная группа P21/a). При нагревании чуть выше температуры плавления (73,6 °C) теряет сперва одну, а затем ещё две молекулы воды.
Плотность водного раствора нитрата алюминия при 18 °C:
| 16 % | 18 % | 20 % | 24 % | 28 % | 30 % | 32 % | — | |
|---|---|---|---|---|---|---|---|---|
| 1 % | 2 % | 4 % | 6 % | 8 % | 10 % | 12 % | 14 % | |
| Плотность, г/л | 1006,5 | 1014,4 | 1030,5 | 1046,9 | 1063,8 | 1081,1 | 1098,9 | 1117,1 |
| 1135,7 | 1154,9 | 1174,5 | 1215,3 | 1258,2 | 1280,5 | 1303,6 | — |
Химические свойства
- При растворении в воде подвергается гидролизу:
- Al(NO3)3 + 4 H2O ⇆ [Al(H2O)4]3+ + 3 NO3−
- [Al(H2O)4]3+ + H2O ⇆ [Al(H2O)3(OH)]2+ + H3O+
- Водные растворы нитрата алюминия имеют pH от 2,5 до 3,7.
- При нагревании гидролиз можно провести полностью:
- Al(NO3)3 + 3 H2O = Al(OH)3 ↓ + 3 HNO3 ↑
- Вступает в реакцию со щелочами:
- Al(NO3)3 + 3 NaOH = Al(OH)3 ↓ + 3 NaNO3
- Al(NO3)3 + 4 NaOH = Na[Al(OH)4] + 3 NaNO3
- Реакция с концентрированным водным раствором аммиака может идти по двум направлениям.
- На холоде:
- Al(NO3)3 + 3 NH3 + 3 H2O = Al(OH)3 ↓ + 3 NH4NO3
- При нагревании:
- Al(NO3)3 + 3 NH3 + 3 H2O = AlO(OH) ↓ + 3 NH4NO3 + H2O
- При нагревании разлагается:
- 4 Al(NO3)3 = 2 Al2O3 + 12 NO2 ↑ + 3 O2 ↑
- Нонагидрат при сильном нагревании (135 °C) сперва образует основную соль Al(OH)2NO3•1,5H2O, а при более высокой температуре (200 °C) разлагается до аморфного оксида алюминия.
- Нитрат алюминия является сильным окислителем — его безводная форма со взрывом реагирует со многими органическими растворителями (например: с диэтиловым эфиром и бензолом).
Получение
Лабораторные методы
В лаборатории водный раствор нитрата алюминия получают растворением алюминия в разбавленной азотной кислоте:
- 8 Al + 30 HNO3 = 8 Al(NO3)3 + 3 N2O ↑ + 15 H2O
Альтернативный метод заключается во взаимодействии гидроксида алюминия с азотной кислотой:
- Al(OH)3 + 3 HNO3 = Al(NO3)3 + 3 H2O
Наконец, искомую соль можно получить обменной реакцией сульфата алюминия с нитратом бария или свинца:
- Al2(SO4)3 + 3 Ba(NO3)2 = 2 Al(NO3)3 + 3 BaSO4 ↓
Из водного раствора посредством кристаллизации выделяют нонагидрат нитрата алюминия. Кристаллогидраты с меньшим количеством воды получают из водных растворов азотной кислоты.
Безводный нитрат алюминия можно получить реакцией кристаллогидрата с избытком оксидом азота V (реакция (1)) или безводного хлорида алюминия с нитратом хлора (реакция (2)):
- Al(NO3)3 ⋅ 9 H2O + 9 N2O5 ⟶ Al(NO3)3+ 18 HNO3 (1)
- AlCl3 + 3 ClNO3 ⟶ Al(NO3)3 + 3 Cl2 (2)
Промышленное производство
В промышленности безводный нитрат алюминия получают взаимодействием оксида или гидроксида алюминия с оксидом азота V:
- Al2O3 + 3 N2O5 ⟶ 2 Al(NO3)3
- Al(OH)3 + 3 N2O5 ⟶ Al(NO3)3 + 3 HNO3
В случае использования бромида алюминия в качестве исходного сырья для синтеза, реакция идёт в две стадии:
- 2 AlBr3 + 8 N2O5 = 2 [NO2]− [Al(NO3)4]+ + 3 Br2 + 6 NO2
- 2 [NO2]− [Al(NO3)4] = 2 Al(NO3)3 + 4 NO2 + O2
Применение
Соединение используется в текстильной промышленности как протрава при крашении тканей, для дубления кожи, в производстве нитей накаливания, в качестве катализатора при очистке нефти, антикоррозионного агента; в производстве изоляционных бумаг, нагревательных элементах, антиперспирантов; в ядерной физике.
Опасность
ЛД50 (крысы, перорально) = 4,28 г/кг.
| Нитрат алюминия | |

|
|
|
|
|
| Общие | |
|---|---|
| Систематическое наименование | Нитрат алюминия |
| Традиционные названия | Нитрат алюминия, тринитрат алюминия, алюминия (III) нитрат |
| Химическая формула | Al(NO3)3 |
| Эмпирическая формула | Al(NO3)3 |
| Физические свойства | |
| Состояние (ст. усл.) | твёрдое |
| Молярная масса | 212,996 г/моль |
| Плотность | 1,89[1] г/см³ |
| Термические свойства | |
| Температура плавления | 66 °C (с разл.)[1]; нонагидрат: 73,5[1] °C |
| Энтальпия образования (ст. усл.) | − 927 кДж/моль; нонагидрат: − 3757[2]; гексагидрат: − 2871[3] кДж/моль |
| Химические свойства | |
| Растворимость в воде | при 25 °C: 63,7 г/100 мл |
| Растворимость в воде | нонагидрат при 20 °C: 73,9[4] |
| Растворимость в в метаноле | при 35 °C: 14,45[5] |
| Растворимость в в этаноле | при 35 °C: 8,63[5] г/100 мл |
| Растворимость в в этиленгликоле | при 35 °C: 18,32[5] |
| Структура | |
| Кристаллическая структура | моноклинная |
| Классификация | |
| Рег. номер CAS | 13473-90-0 7784-27-2 (нонагидрат) |
| SMILES | [Al+3].O=[N+]([O-])[O-].[O-][N+]([O-])=O.[O-][N+]([O-])=O |
| Регистрационный номер EC | 236-751-8 |
| RTECS | BD1040000 BD1050000 (нонагидрат) |
| Безопасность | |
| ЛД50 | (крысы, перорально) 4280 мг/кг |
Нитра́т алюми́ния, азотнокислый алюминий — Al(NO3)3, неорганическое соединение, алюминиевая соль азотной кислоты.
Помимо собственно безводного нитрата, у алюминия существуют и основные нитраты: AlOH(NO3)2 и Al(OH)2NO3, а также ряд гидратированных солей Al(NO3)3•xH2O (х = 4, 6, 8, 9), среди которых наиболее стабилен нонагидрат: Al(NO3)3•9H2O.
Содержание
- 1 Физические свойства
- 2 Химические свойства
- 3 Получение
- 3.1 Лабораторные методы
- 3.2 Промышленное производство
- 4 Применение
- 5 Опасность
- 6 Примечания
- 7 Литература
- 8 Ссылки
Физические свойства
Безводный нитрат алюминия представляет собой белое или бесцветное кристаллическое, чрезвычайно гигроскопичное вещество, дымящее на воздухе[2][6]. Хорошо растворим в холодной воде (63,7 % при 25 °C) и полярных органических растворителях[6]. Температура плавления 66 °C (с разложением), в вакууме возгоняется при 50 °C[2].
Нонагидрат Al(NO3)3•9H2O — белые кристаллы, расплывающееся на воздухе, с моноклинной структурой (a=1,086 нм, b=0,959 нм, c=1,383 нм, β=95,15°, z=4, пространственная группа P21/a). При нагревании чуть выше температуры плавления (73,6 °C) теряет сперва одну, а затем ещё две молекулы воды[2].
Плотность водного раствора нитрата алюминия при 18 °C[7]:
| 1 % | 2 % | 4 % | 6 % | 8 % | 10 % | 12 % | 14 % | |
|---|---|---|---|---|---|---|---|---|
| Плотность, г/л | 1006,5 | 1014,4 | 1030,5 | 1046,9 | 1063,8 | 1081,1 | 1098,9 | 1117,1 |
| 16 % | 18 % | 20 % | 24 % | 28 % | 30 % | 32 % | — | |
| 1135,7 | 1154,9 | 1174,5 | 1215,3 | 1258,2 | 1280,5 | 1303,6 | — |
Химические свойства
- При растворении в воде подвергается гидролизу[8]:
- Водные растворы нитрата алюминия имеют pH от 2,5 до 3,7[9].
- При нагревании гидролиз можно провести полностью[8]:
- Вступает в реакцию со щелочами:
- Реакция с концентрированным водным раствором аммиака может идти по двум направлениям[8].
- На холоде:
- При нагревании:
- При нагревании разлагается [8]:
- Нонагидрат при сильном нагревании (135 °C) сперва образует основную соль Al(OH)2NO3•1,5H2O, а при более высокой температуре (200 °C) разлагается до аморфного оксида алюминия[10].
- Нитрат алюминия является сильным окислителем — его безводная форма со взрывом реагирует со многими органическими растворителями (например: с диэтиловым эфиром и бензолом).
Получение
Лабораторные методы
В лаборатории водный раствор нитрата алюминия получают растворением алюминия в разбавленной азотной кислоте:
Альтернативный метод заключается во взаимодействии гидроксида алюминия с азотной кислотой:
Наконец, искомую соль можно получить обменной реакцией сульфата алюминия с нитратом бария или свинца:
Из водного раствора посредством кристаллизации выделяют нонагидрат нитрата алюминия. Кристаллогидраты с меньшим количеством воды получают из водных растворов азотной кислоты[10].
Безводный нитрат алюминия можно получить реакцией кристаллогидрата с избытком оксидом азота (V) (реакция (1)) или безводного хлорида алюминия с нитратом хлора (реакция (2))[10][11]:
Промышленное производство
В промышленности безводный нитрат алюминия получают взаимодействием оксида или гидроксида алюминия с оксидом азота (V)[8]:
В случае использования бромида алюминия в качестве исходного сырья для синтеза, реакция идёт в две стадии:
Применение
Соединение используется в текстильной промышленности как протрава при крашении тканей, для дубления кожи, в производстве нитей накаливания, в качестве катализатора при очистке нефти, антикоррозионного агента; в производстве изоляционных бумаг, нагревательных элементах, антиперспирантов; в ядерной физике[12].
Опасность
ЛД50 (крысы, перорально) = 4,28 г/кг[13].
Примечания
- ↑ 1 2 3 Лидин Р.А., Андреева Л.Л., Молочко В.А. Глава 3. Физические свойства // Константы неорганических веществ: справочник / Под редакцией проф. Р.А.Лидина. — 2-е изд., перераб. и доп.. — М.: «Дрофа», 2006. — С. 76. — ISBN 5-7107-8085-5
- ↑ 1 2 3 4 Алюминия нитрат // Химическая энциклопедия / Главный редактор И. Л. Кнунянц. — М.: «Советская энциклопедия», 1988. — Т. 1. — С. 212.
- ↑ Лидин Р.А., Андреева Л.Л., Молочко В.А. Часть IV. Термодинамика. Глава 1. Энтальпия образования, энтропия и энергия Гиббса образования веществ // Константы неорганических веществ: справочник / Под редакцией проф. Р.А.Лидина. — 2-е изд., перераб. и доп.. — М.: «Дрофа», 2006. — С. 441. — ISBN 5-7107-8085-5
- ↑ Лидин Р.А., Андреева Л.Л., Молочко В.А. Часть VI. Растворимость веществ в воде // Константы неорганических веществ: справочник / Под редакцией проф. Р.А.Лидина. — 2-е изд., перераб. и доп.. — М.: «Дрофа», 2006. — С. 618. — ISBN 5-7107-8085-5
- ↑ 1 2 3 Perry D.L. , Phillips S.L. Handbook of Inorganic Compounds. — CRC Press, 1995. — P. 9. — ISBN 0-8493-8671-3
- ↑ 1 2 Patnaik P. Handbook of inorganic chemical. — McGraw-Hill, 2003. — P. 9. — ISBN 0-07-049439-8
- ↑ Лидин Р.А., Андреева Л.Л., Молочко В.А. Часть VII. Плотность воды и водных растворов. Глава 3. Соли // Константы неорганических веществ: справочник / Под редакцией проф. Р.А.Лидина. — 2-е изд., перераб. и доп.. — М.: «Дрофа», 2006. — С. 641. — ISBN 5-7107-8085-5
- ↑ 1 2 3 4 5 Лидин Р.А., Молочко В.А., Андреева Л.Л. Химические свойства неорганических веществ / Под редакцией проф. Р.А.Лидина. — 3-е изд.. — М.: «Химия», 2000. — С. 84. — ISBN 5-7245-1163-0
- ↑ Тихонов В.Н. Аналитическая химия алюминия. — Серия «Аналитическая химия элементов». — М.: «Наука». — Т. 1971. — С. 16.
- ↑ 1 2 3 Downs A.J. Chemistry of aluminium, gallium, indium, and thallium. — First edition. — London: Chapman & Hall, 1993. — P. 153. — 526 p. — ISBN 0-7514-0103-X
- ↑ Турова Н.Я. Неорганическая химия в таблицах. — М.: «Высший химический колледж РАН», 1997. — С. 66.
- ↑ Vincoli J. W. Aluminium nitrate // Risk Management for Hazardous Chemicals. — CRC Press, 1997. — Т. 1. — 3136 p. — ISBN 1-56670-200-3
- ↑ Gardner’s commercially important chemicals: synonyms, trade names, and properties / Edited by Milne G.W.A.. — New Jersey: John Wiley and Sons, 2005. — P. 22. — ISBN 0-471-73518-3
Литература
- Downs A.J. Chemistry of aluminium, gallium, indium, and thallium. — First edition. — London: Chapman & Hall, 1993. — 526 p. — ISBN 0-7514-0103-X
Ссылки
- Синтез нитрата алюминия на сайте Youtube. (англ.)
|
Нитраты |
|
|---|---|
|
Динитрат гидразина (N2H6(NO3)2) • Изопентилнитрат ((CH3)2CHCH2CH2ONO2) • Метилнитрат (CH3ONO2) • Нитрат актиния(III) (Ac(NO3)3) • Нитрат алюминия (Al(NO3)3) • Нитрат аммония (NH4NO3) • Нитрат бария (Ba(NO3)2) • Нитрат берилия (Be(NO3)2) • Нитрат висмута (Bi(NO3)3) • Нитрат гадолиния (Gd(NO3)3) • Нитрат гидразина (N2H5NO3) • Нитрат гидроксиламина ((NH3OH)NO3) • Нитрат гуанидина (C(NH2)3NO3) • Нитрат железа(III) (Fe(NO3)3) • Нитрат кадмия (Cd(NO3)2) • Нитрат калия (KNO3) • Нитрат кальция (Са(NО3)2) • Нитрат кобальта(II) (Co(NO3)2) • Нитрат кобальта(III) (Co(NO3)3) • Нитрат лития (LiNO3) • Нитрат магния (Mg(NO3)2) • Нитрат марганца (Mn(NO3)2) • Нитрат меди(II) (Cu(NO3)2) • Нитрат мочевины ((NH2)2CO•HNO3) • Нитрат натрия (NaNO3) • Нитрат неодима (Nd(NO3)3) • Нитрат никеля(II) (Ni(NO3)2) • Нитрат палладия(II) (Pd(NO3)3) • Нитрат ртути(I) (Hg2(NO3)2) • Нитрат ртути(II) (Hg(NO3)2) • Нитрат рубидия (RbNO3) • Нитрат свинца(II) (Pb(NO3)2) • Нитрат серебра(I) (AgNO3) • Нитрат скандия(III) (Sc(NO3)3) • Нитрат стронция (Sr(NO3)2) • Нитрат урана (U(NO3)2) • Нитрат уранила (UO2(NO3)2) • Нитрат хлорина (ClONO3) • Нитрат хрома (Cr(NO3)3) • Нитрат цезия (CsNO3) • Нитрат цинка (Zn(NO3)2) • Нитраты целлюлозы ([C6H7O2(OH)3-x(ONO2)x]n) • Нитроглицерин (O2NOCH(CH2ONO2)2) • Пропилнитрат (C3H7ONO2) • Церий-аммоний нитрат ((NH4)2Ce(NO3)6) • Этилнитрат (C2H5ONO2) |
 |
|
Соединения алюминия |
|---|
|
Алюминат лития (LiAlO2) • Алюминат натрия (NaAlO2) • Алюмогидрид кальция (Ca[AlH4]2) • Алюмогидрид лития (LiAlH4) • Алюмосиликаты • Антимонид алюминия (AlSb) • Арсенид алюминия (AlAs) • Ацетат алюминия (Al(CH3COO)3) • Бромид алюминия (AlBr3) • Гексафтороалюминат аммония ((NH3)3[AlF6]) • Гексафтороалюминат натрия (Na3[AlF6]) • Гидрид алюминия (AlH3) • Гидроксид алюминия (Al(OH)3) • Диборид алюминия (AlB2) • Додекаборид алюминия (AlB12) • Иодид алюминия (AlI3) • Карбид алюминия (Al4C3) • Метагидроксид алюминия (AlO(OH)) • Молибдат алюминия (Al2(MoO4)3) • Монооксид алюминия (AlO) • Монофторид алюминия (AlF) • Монохлорид алюминия (AlCl) • Нитрат алюминия (Al(NO3)3) • Нитрид алюминия (AlN) • Оксид алюминия (Al2O3) • Оксинитрид алюминия (AlON) • Селенид алюминия (Al2Se3) • Силикат алюминия (Al2SiO5) • Сульфат алюминия (Al2(SO4)3) • Сульфат алюминия-калия (KAl(SO4)2) • Сульфид алюминия (Al2S3) • Тетрагидридоалюминат лития (Li[AlH4]) • Тетрагидридоалюминат натрия (Na[AlH4]) • Тетрагидридоалюминат калия (K[AlH4]) • Тетрагидридоалюминат цезия (Cs[AlH4]) • Триизобутилалюминий (Al(C4H9)3) • Триметилалюминий (Al(CH3)3) • Трифенилалюминий (Al(C6H5)3) • Трифторид алюминия (AlF3) • Триэтилалюминий (Al(C2H5)3) • Фосфат алюминия (AlPO4) • Фосфид алюминия (AlP) • Хлорид алюминия (AlCl3) |
|
Растворимость кислот, оснований и солей в воде |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
Нитрат алюминия
Поиск химических веществ по названиям или формулам.
|
Справочник содержит названия веществ и описания химических формул (в т.ч. структурные формулы и скелетные формулы). Введите часть названия или формулу для поиска: Нитрат алюминия
Брутто-формула: Названия Русский:
English:
Варианты формулы:
|
Химия — Нитрат алюминия — Химические свойства
01 марта 2011
Оглавление:
1. Нитрат алюминия
2. Химические свойства
3. Применение
- При растворении в воде подвергается гидролизу:
- Водные растворы нитрата алюминия имеют pH от 2,5 до 3,7.
- При нагревании гидролиз можно провести полностью:
- Вступает в реакцию со щелочами:
- Реакция с концентрированным водным раствором аммиака может идти по двум направлениям.
- На холоду:
- При нагревании:
- При нагревании разлагается :
- Нонагидрат при сильном нагревании сперва образует основную соль Al2NO3•1,5H2O, а при более высокой температуре разлагается до аморфного оксида алюминия.
- Нитрат алюминия является сильным окислителем его безводная форма со взрывом реагирует со многими органическими растворителями.
Получение
Лабораторные методы
В лаборатории водный раствор нитрата алюминия получают растворением алюминия в разбавленной азотной кислоте:
Альтернативный метод заключается во взаимодействии гидроксида алюминия с азотной кислотой:
Наконец, искомую соль можно получить обменной реакцией сульфата алюминия с нитратом бария или свинца:
Из водного раствора посредством кристаллизации выделяют нонагидрат нитрата алюминия. Кристаллогидраты с меньшим количеством воды получают из водных растворов азотной кислоты.
Безводный нитрат алюминия можно получить реакцией кристаллогидрата с избытком оксидом азота) или безводного хлорида алюминия с нитратом хлора):
Промышленное производство
В промышленности безводный нитрат алюминия получают взаимодействием оксида или гидроксида алюминия с оксидом азота:
В случае использования бромида алюминия в качестве исходного сырья для синтеза, реакция идёт в две стадии:
Просмотров: 4911
Определение и формула нитрата алюминия
Хорошо растворяется в воде (гидролизуется по катиону). Растворяется в азотной кислоте. Реагирует со щелочами, гидратом аммиака.
Рис. 1. Нитрат алюминия. Внешний вид.
Химическая формула нитрата алюминия
Химическая формула нитрата алюминия Al(NO3)3. Она показывает, что в состав данной молекулы входят один атом алюминия (Ar = 27 а.е.м.), три атома азота (Ar = 14 а.е.м.) и девять атомов кислорода (Ar = 16 а.е.м.). По химической формуле можно вычислить молекулярную массу нитрата алюминия:
Mr(Al(NO3)3) = Ar(Al) + 3×Ar(N) + 9×Ar(O);
Mr(Al(NO3)3) = 27 + 3×14 + 9×16 = 27 + 42 + 144 = 213.
Графическая (структурная) формула нитрата алюминия
Структурная (графическая) формула нитрата алюминия является более наглядной. Она показывает то, как связаны атомы между собой внутри молекулы:
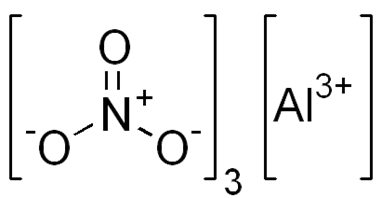
Ионная формула
Нитрат алюминия представляет собой электролит, который диссоциирует на ионы в водном растворе согласно следующему уравнению реакции:
Al(NO3)3 ↔ Al3+ + 3NO3—.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Нитрид алюминия как пишется
Serg Morgan
Ученик
(131),
закрыт
7 лет назад
Лучший ответ
Роман
Профи
(605)
7 лет назад
Нитрат натрия — NaNO₃
Нитрат магния — Mg(NO₃)₂
Нитрат алюминия — Al(NO₃)₃
Serg MorganУченик (131)
7 лет назад
а нитрат бария Ba(NO3)2
Конечно
Остальные ответы
Free Sweeper
Искусственный Интеллект
(126037)
7 лет назад
Так и пишется — НИТРАТ (соль азотной кислоты)
From Wikipedia, the free encyclopedia

|
|

|
|
| Names | |
|---|---|
| IUPAC name
Aluminium nitrate |
|
| Other names
Nitric Aluminum salt |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChemSpider |
|
| ECHA InfoCard | 100.033.396 |
| EC Number |
|
|
PubChem CID |
|
| RTECS number |
|
| UNII |
|
| UN number | 1438 |
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
Al(NO3)3 |
| Molar mass | 212.996 g/mol (anhydrous) 375.134 g/mol (nonahydrate) |
| Appearance | White crystals, solid hygroscopic |
| Odor | odorless |
| Density | 1.72 g/cm3 (nonahydrate) |
| Melting point | 66 °C (151 °F; 339 K) (anhydrous)[1] 73.9 °C (165.0 °F; 347.0 K) (nonahydrate) |
| Boiling point | 150 °C (302 °F; 423 K) (nonahydrate) decomposes |
|
Solubility in water |
anhydrous: 60.0 g/100ml (0°C) 73.9 g/100ml (20 °C) 160 g/100ml (100 °C) nonahydrate: 67.3 g/100 mL |
| Solubility in methanol | 14.45 g/100ml |
| Solubility in ethanol | 8.63 g/100ml |
| Solubility in ethylene glycol | 18.32 g/100ml |
|
Refractive index (nD) |
1.54 |
| Hazards | |
| GHS labelling: | |
|
Pictograms |
    
|
|
Signal word |
Danger |
|
Hazard statements |
H271, H272, H301, H315, H318, H319, H361 |
|
Precautionary statements |
P201, P202, P210, P220, P221, P264, P270, P280, P281, P283, P301+P310, P302+P352, P305+P351+P338, P306+P360, P308+P313, P310, P321, P330, P332+P313, P337+P313, P362, P370+P378, P371+P380+P375, P405, P501 |
| NFPA 704 (fire diamond) |
2 0 1 OX |
| Flash point | 35 °C (95 °F; 308 K) (nonahydrate) |
| Lethal dose or concentration (LD, LC): | |
|
LD50 (median dose) |
4280 mg/kg, oral (rat) |
| NIOSH (US health exposure limits): | |
|
PEL (Permissible) |
none[2] |
|
REL (Recommended) |
2 mg/m3[2] |
|
IDLH (Immediate danger) |
N.D.[2] |
| Safety data sheet (SDS) | External MSDS |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Aluminium nitrate is a white, water-soluble salt of aluminium and nitric acid, most commonly existing as the crystalline hydrate, aluminium nitrate nonahydrate, Al(NO3)3·9H2O.
Preparation[edit]
Aluminium nitrate cannot be synthesized by the reaction of aluminium with concentrated nitric acid, as the aluminium forms a passivation layer.
Aluminium nitrate may instead be prepared by the reaction of nitric acid with aluminium(III) chloride. Nitrosyl chloride is produced as a by-product; it bubbles out of the solution as a gas. More conveniently, the salt can be made by reacting nitric acid with aluminium hydroxide.
Aluminium nitrate may also be prepared a metathesis reaction between aluminium sulfate and a nitrate salt with a suitable cation such as barium, strontium, calcium, silver, or lead. e.g. Al2(SO4)3 + 3 Ba(NO3)2 → 2 Al(NO3)3 + 3 BaSO4.
Uses[edit]
Aluminium nitrate is a strong oxidizing agent. It is used in tanning leather, antiperspirants, corrosion inhibitors, extraction of uranium, petroleum refining, and as a nitrating agent.
The nonahydrate and other hydrated aluminium nitrates have many applications. These salts are used to produce alumina for preparation of insulating papers, in cathode ray tube heating elements, and on transformer core laminates. The hydrated salts are also used for the extraction of actinide elements.[3]
It is used in the laboratory and classroom such as in the reaction
- Al(NO3)3 + 3 NaOH → Al(OH)3 + 3 NaNO3
It is, however, much less often encountered than aluminium chloride and aluminium sulfate.
References[edit]
- ^ «aluminum nitrate».
- ^ a b c NIOSH Pocket Guide to Chemical Hazards. «#0024». National Institute for Occupational Safety and Health (NIOSH).
- ^ Pradyot Patnaik. Handbook of Inorganic Chemicals. McGraw-Hill, 2002, ISBN 0-07-049439-8.
External links[edit]
- MSDS of nonahydrate
- Government of Canada Fact Sheets and Frequently Asked Questions: Aluminum Salts
- v
- t
- e
Salts and covalent derivatives of the nitrate ion



![mathsf{Al(NO_3)_3+4H_2Oleftrightarrows[Al(H_2O)_4]^{3+}+3NO_3^-}](https://dic.academic.ru/dic.nsf/ruwiki/3590061cd329bbcb63d218f41f79fadb.png)
![mathsf{[Al(H_2O)_4]^{3+}+H_2Oleftrightarrows[Al(H_2O)_3(OH)]^{2+}+H_3O^+}](https://dic.academic.ru/dic.nsf/ruwiki/51e539c3c99b08e5edf9857931a76ac0.png)


![mathsf{Al(NO_3)_3+4NaOH=Na[Al(OH)_4]+3NaNO_3}](https://dic.academic.ru/dic.nsf/ruwiki/3e4cca326b0fa8613342d4478e7a43c3.png)










![mathsf{2AlBr_3+8N_2O_5=2[NO_2]^-[Al(NO_3)_4]^++3Br_2+6NO_2}](https://dic.academic.ru/dic.nsf/ruwiki/8900cd7c35ef6af87b6ff747d42b9dea.png)
![mathsf{2[NO_2]^-[Al(NO_3)_4]=2Al(NO_3)_3+4NO_2+O_2}](https://dic.academic.ru/dic.nsf/ruwiki/65c89ebe7a8bcb516c787fd13fc143b9.png)













