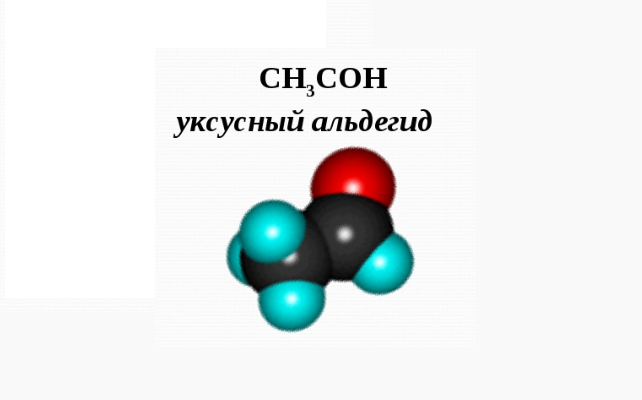
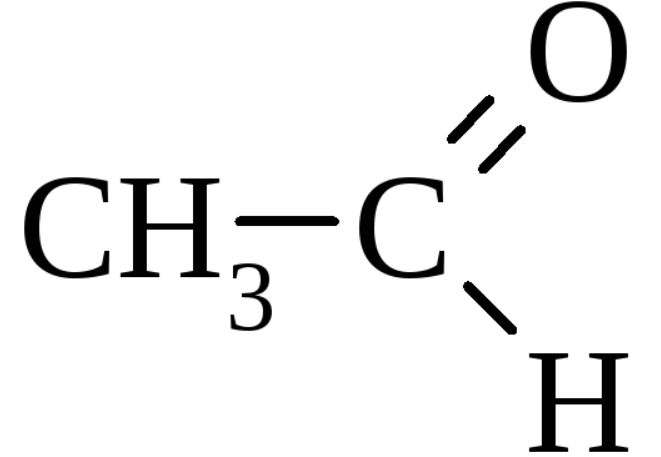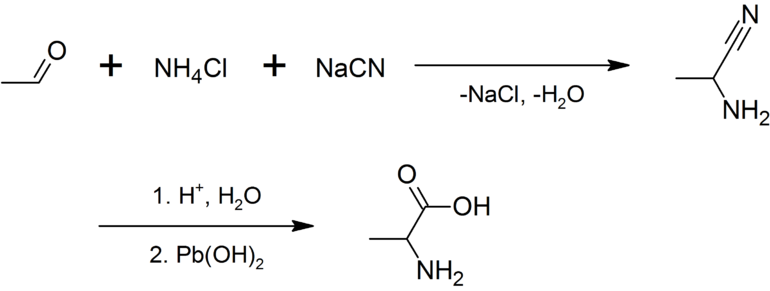Уксусный альдегид

4.6
Средняя оценка: 4.6
Всего получено оценок: 136.
4.6
Средняя оценка: 4.6
Всего получено оценок: 136.
Уксусный альдегид относится к органическим соединениям и входит в класс альдегидов. Какими свойствами обладает это вещество, и как выглядит формула уксусного альдегида?
Общая характеристика
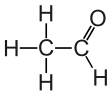
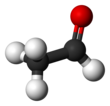
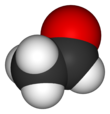
Уксусный альдегид имеет несколько названий: ацетальдегид, этаналь, метилформальдегид. Это соединение является альдегидом уксусной кислоты и этанола. Его структурная формула выглядит следующим образом: CH3-CHO.
Особенностью этого альдегида является то, что он встречается как в природе, так и производится искусственным путем. В промышленности объем производства этого вещества может составлять до 1 миллиона тонн в год.
Этаналь встречается в пищевых продуктах, таких как кофе, хлеб, а также это вещество синтезируют растения в процессе метаболизма.
Уксусный альдегид представляет собой жидкость без цвета, но отличающуюся резким запахом. Растворим в воде, спирте и эфире. Является ядовитым.
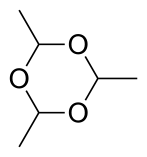
Жидкость закипает при достаточно низкой температуре – 20,2 градуса по Цельсию. Из-за этого возникают проблемы с ее хранением и транспортировкой. Поэтому хранят вещество в виде паральдегида, а ацетальдегид из него получают в случае необходимости путем нагревания с серной кислотой (либо с любой другой минеральной кислотой). Паральдегид – это циклический тример уксусной кислоты.
Способы получения
Получить уксусный альдегид можно несколькими способами. Самый распространенный вариант – окисление этилена или, как еще называют этот способ, процесс Вакера:
2CH2=CH2+O2 —2CH3CHO
Окислителем в данной реакции выступает хлорид палладия.
Также уксусный альдегид можно получить пр взаимодействии ацетилена с солями ртути. Данная реакция носит имя русского ученого и называется реакцией Кучерова. В результате химического процесса образуется енол, который изомеризуется в альдегид
C2H2+H2O=CH3CHO
До открытия метода Вакера в 60-ые годы уксусный альдегид получали при помощи этилового спирта. Этиловый спирт окисляли или дегидрировали. В качестве катализатора выступали медь или серебро:
C2H5OH–CH3COH+H2
2C2H5OH+O2=2CH3OH+2H2O
По химическим свойствам ацетальдегид является типичным представителем альдегидов.
Применяют в промышленности данное вещество для получения уксусной кислоты, бутадиена и различных органических веществ.
Что мы узнали?
Уксусный альдегид – жидкость, имеющая несколько названий. Это вещество имеет свойство кипеть уже при температуре 20,2 градуса. Существуют два основных способа с помощью которых получают этот альдегид: реакция Вакера и реакция Кучерова.
Тест по теме
Доска почёта

Чтобы попасть сюда — пройдите тест.
Пока никого нет. Будьте первым!
Оценка доклада
4.6
Средняя оценка: 4.6
Всего получено оценок: 136.
А какая ваша оценка?
Альдегид уксусный
- Альдегид уксусный
-
Обыкновенный, или уксусный, альдегид — наиболее давно известный член группы альдегидов (см. это сл.), имеющий состав C2H4O. Деберейнер, подобно другим химикам, получал это вещество в смеси с другими при окислении обыкновенного алкоголя действиями смеси серной кислоты с двухромовокалиевой солью или перекисью марганца; в течение долгого времени оно было известно под названием легкого кислородного эфира. Либих, изучивший это соединение точнее, впервые определил его натуру и дал ему теперешнее название, происходящее от сокращения слов Al(cohol) dehyd(rogeniatus), т. е. алкоголь обезводороженный. Для его приготовления Либих советует поступить так: в объемистую колбу помещают 4 части 80° алкоголя (по Траллесу) и 6 частей перекиси марганца и приливают в нее охлажденную смесь 4 ч. воды с 6 ч. концентрированной серной кислоты; затем отгоняют при возможно низкой температуре и собирающийся при этом дистиллят возможно тщательно охлаждают; отгонку прекращают, как только в перегоне появится кислая реакция. Полученный продукт сушат над хлористым кальцием и перегоняют; затем альд. растворяют в эфире и насыщают при охлаждении сухим аммиаком, при чем образуется кристаллическое соединение альдегида с аммиаком, так наз. альдегидаммиак, который при стоянии сполна осаждается из эфирного раствора. Альдегидаммиак разлагается слабой серной кислотой и отгоняется на водяной бане; переходящий при этом весьма летучий альдегид обезвоживается взбалтыванием с хлористым кальцием и еще раз подвергается дробной перегонке. В настоящее время альдегид в больших количествах получается при дефлегтации сырого спирта в так наз. приголовке, из которого он и добывается заводским способом. Альдегид представляет бесцветную легкоподвижную жидкость, смешивающуюся во всех пропорциях с водою, спиртом и эфиром, с довольно резким и удушливым запахом; он кипит при 20,8°; уд. в. = 0,8009 (коин). В соприкосновении с воздухом альдегид присоединяет кислород, при чем превращается в уксусную кислоту; при нагревании ее разведенным аммиачным раствором окиси серебра происходит выделение металлического серебра, осаждающегося в виде зеркала по стенкам сосуда; амальгама натрия, действуя на водный раствор альдегида, дает этиловый спирт, происходящий на счет присоединения к альдегиду двух паев водорода. С аммиаком, а также с кислыми сернистокислыми щелочами альдегид дает кристаллические соединения. При действии хлора на воду, содержащую альдегид, происходит хлоралгидрат (см. это сл.). Если через алкогольный раствор альдегидаммиака пропускать сероводород, то при этом выделяются крупные кристаллы миалдина C6H13NS2. Одно из самых интереснейших превращений альдегида — это способность его к уплотнению под влиянием многих реактивов. Так, многие минеральные кислоты, взятые даже в весьма малых количествах, напр. капля крепкой серной кислоты, довольно быстро превращают его в жидкий паральдегид, кипящ. при 123° и имеющий утроенную частицу, т. е. С6H12О3; если действие энергичной кислоты совершается на холоде, то появляются кристаллы твердого полимера альдегида, называемого метальдегидом. Как паральдегид, так и метальдегид характеризуются тем отличительным свойством, что уже при нагревании они вновь переходят, хотя и не сполна, в простое мономерное состояние альдегида. Почти при тех же условиях наряду с указанными полимерами образуются также продукты совсем иного характера, неспособные уже обратно переходить в альдегид; из них наибольшего интереса заслуживает алдоль, иначе альдегид оксимасляной кислоты С4Н8О2, по своему частичному составу как бы удвоенный уксусный альдегид, но уже представляющийся производным веществом с 4-мя паями углерода, взаимно и прочно соединенными друг с другом (см. Алдоль); чаще вместо алдоля образуется кротоновый альдегид С4Н6О, происходящий из первого выделением элементов воды. В технике альдегид употребляется при серебрении стекол и при производстве серебряных зеркал. Если, например, нагреть водный раствор альдегида с азотнокислым серебром и небольш. колич. нашатырного спирта, то стенки сосуда или стеклянная пластинка, помещенная на поверхности жидкости, быстро покрываются блестящим серебристым зеркалом. Кроме того, альдегид идет в технику для приготовления зеленой и фиолетовой анилиновой краски, а также как примесь к фруктовым эссенциям. Вследствие способности альдегида превращаться под влиянием кислорода в уксусную кислоту предлагали употреблять его для сохранения мяса и других питательных веществ.
Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона. — С.-Пб.: Брокгауз-Ефрон.
1890—1907.
Полезное
Смотреть что такое «Альдегид уксусный» в других словарях:
-
альдегид-уксусный — альдеги/д у/ксусный … Слитно. Раздельно. Через дефис.
-
АЛЬДЕГИД — Алкоголь, утративший часть водорода. Объяснение 25000 иностранных слов, вошедших в употребление в русский язык, с означением их корней. Михельсон А.Д., 1865. АЛЬДЕГИД Легко окисляющаяся летучая жидкость, состоящая из алкоголя, образовавшегося… … Словарь иностранных слов русского языка
-
УКСУСНЫЙ АЛЬДЕГИД — то же, что ацетальдегид … Большой Энциклопедический словарь
-
УКСУСНЫЙ АЛЬДЕГИД — (ацетальдегид) СН3СНО летучая бесцветная жидкость с резким запахом прелых яблок (в них и содержится), хорошо растворяется в воде, спирте, эфире; ίκππ = 21 °С. У. а. получают окислением этилового спирта млн. гидратацией ацетилена в присутствии… … Большая политехническая энциклопедия
-
Уксусный альдегид — Ацетальдегид Общие Химическая формула C2H4O Молярная масса 44.05 г/моль Физические свойства … Википедия
-
Альдегид — обыкновенный или уксусный альдегид наиболее давно известный член группы альдегидов (см.), имеющий состав C 2H4 O. Деберейнер, подобно другим химикам, получал это вещество в смеси с другими при окислении обыкновенного алкоголя действиями смеси… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
-
уксусный альдегид — то же, что ацетальдегид. * * * УКСУСНЫЙ АЛЬДЕГИД УКСУСНЫЙ АЛЬДЕГИД, то же, что ацетальдегид (см. АЦЕТАЛЬДЕГИД) … Энциклопедический словарь
-
уксусный альдегид — acetaldehidas statusas T sritis chemija formulė CH₃CHO atitikmenys: angl. acetaldehyde rus. ацетальдегид; уксусный альдегид ryšiai: sinonimas – etanalis … Chemijos terminų aiškinamasis žodynas
-
УКСУСНЫЙ АЛЬДЕГИД — то же, что ацеталъдегид. УКСУСНЫЙ АНГИДРИД (CH3CO)2O, мол. м. 102,09; бесцв. прозрачная подвижная жидкость с резким запахом; т. пл. 73,1 X т. кип. 139,60C: 1,0820; 1,3906; t крит 295,8 0C, р криг 4,6 МПа; 0,901 мПа … Химическая энциклопедия
-
уксусный альдегид — (син.: ацетальдегид, этаналь) простейший природный альдегид ациклического ряда, промежуточный продукт спиртового брожения; участвует в цикле трикарбоновых к т; производные У. а. применяются в качестве лекарственных средств … Большой медицинский словарь
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Историческая справка
Датой первого обнаружения элемента шведским фармацевтом Карлом Вильгельмом Шееле принято считать 1774 год. Позже он был неоднократно исследован химиками Антуаном Франсуа и графом де Фуркруа. В 1835 году немецкий учёный Юстус фон Либих обозначит вещество как «альдегид». В ходе дальнейших изучений элемент получил нынешнее название.
Отличительные свойства
Бесцветная жидкость, растворимая в эфире, спирте и воде. Имеет резкий удушливый запах ввиду наличия в химическом составе СН3. Температура кипения составляет плюс 20 °C. Плотность — 0.788 г/см3. Для получения уксусного альдегида паральдегид нагревается вместе с неорганической кислотой. Данное вещество может выполнять функцию безводного монометра.
Взаимодействие с элементами
Продукты взаимодействия метилформальдегида с другими веществами — аланин, имины и стабильные ацетали. Для проведения реакции получения стабильных ацеталей производится соединение ацетальальдегида с этиловым спиртом. Аланин можно выделить гидролизом цианида hcn и аммиака. Имины нередко используются в качестве компонента для проведения адольной конденсации. На основе метилформальдегида строится синтез гетероциклических соединений. В качестве примера можно привести конверсию до альдегид-коллидина.
Циклический тример паральдегид, содержащий одиночные С-О связи, получают в результате конденсации трёх молекул этаналя. Кроме этого, существует кристаллический полимер, называемый метальдегидом, который является стереоизомером паральдегида.
Реакционную способность уксусного альдегида определяют два фактора:
- активность карбонила альдегидной группы;
- подвижность атомов водорода.
Воздействие едких щелочей способствует образованию альдегидной смолы.
Применение и безопасность
Ацетальдегид ch3cho используется в качестве сырья для получения бутадиена, альдегидных полимеров и ряда органических соединений. В конденсирующих реакциях выполняет роль источника синтона. При окислении уксусного альдегида, за счёт присоединения атома кислорода, образуется одноимённая кислота. Катализаторами для проведения данной реакции могут являться пятиокись ванадия, марганцевые соединения и окись урана.
В человеческом организме альдегидное вещество участвует в некоторых сложных реакциях. Нередко встречается в кофе, хлебе и спелых фруктах. Является результатом синтеза растений. На основе ацетальдегида производят восстановители для зеркал, хинальдин, применяемый для создания красок, а также изготавливают снотворные лекарственные препараты.
Можно выделить основные пути, через которые способны взаимодействовать рассматриваемый элемент и человеческий организм:
- воздух;
- грунт;
- подземные воды.
Метилформальдегид оказывает токсичное воздействие, контактируя с кожными покровами. Вещество загрязняет окружающую атмосферу в процессе горения, присутствует в автомобильных выхлопах. Образуется при применении технологии термообработки для полимеров и пластмасс.
Как получить метилформальдегид
С целью выделения рассматриваемого вещества проводится реакция окисления этилена хлоридом палладия. Другой способ получения с помощью ацетата — гидратация ацетилена С2Н2 с участием солей ртути при температуре 90 °C. Также уксусный альдегид получают окислением этанола в присутствии медного или серебряного катализатора, нагретого до температуры 650 °C. Побочным продуктом экзотермической реакции является вода.
Менее всего распространён способ получения гидроформилированием метанола. В качестве катализаторов применяются кобальтовые, никелевые или железные соли. Селективность метилформальдегида, образованного из синтез-газа, сравнительно небольшая.
В промышленности этот метод выделения элемента не практикуется.
Уксусный альдегид — важный продукт химической промышленности. В последнее время его добыча значительно удешевилась. Это даёт возможность создавать на его основе новые синтетические производства.
АЛЬДЕГИД УКСУСНЫЙ
Обыкновенный, или уксусный, альдегид — наиболее давно известный член группы альдегидов (см. это сл.), имеющий состав C2H4O. Деберейнер, подобно другим химикам, получал это вещество в смеси с другими при окислении обыкновенного алкоголя действиями смеси серной кислоты с двухромовокалиевой солью или перекисью марганца; в течение долгого времени оно было известно под названием легкого кислородного эфира. Либих, изучивший это соединение точнее, впервые определил его натуру и дал ему теперешнее название, происходящее от сокращения слов Al(cohol) dehyd(rogeniatus), т. е. алкоголь обезводороженный. Для его приготовления Либих советует поступить так: в объемистую колбу помещают 4 части 80° алкоголя (по Траллесу) и 6 частей перекиси марганца и приливают в нее охлажденную смесь 4 ч. воды с 6 ч. концентрированной серной кислоты; затем отгоняют при возможно низкой температуре и собирающийся при этом дистиллят возможно тщательно охлаждают; отгонку прекращают, как только в перегоне появится кислая реакция. Полученный продукт сушат над хлористым кальцием и перегоняют; затем альд. растворяют в эфире и насыщают при охлаждении сухим аммиаком, при чем образуется кристаллическое соединение альдегида с аммиаком, так наз. альдегидаммиак, который при стоянии сполна осаждается из эфирного раствора. Альдегидаммиак разлагается слабой серной кислотой и отгоняется на водяной бане; переходящий при этом весьма летучий альдегид обезвоживается взбалтыванием с хлористым кальцием и еще раз подвергается дробной перегонке. В настоящее время альдегид в больших количествах получается при дефлегтации сырого спирта в так наз. приголовке, из которого он и добывается заводским способом. Альдегид представляет бесцветную легкоподвижную жидкость, смешивающуюся во всех пропорциях с водою, спиртом и эфиром, с довольно резким и удушливым запахом; он кипит при 20,8°; уд. в. = 0,8009 (коин). В соприкосновении с воздухом альдегид присоединяет кислород, при чем превращается в уксусную кислоту; при нагревании ее разведенным аммиачным раствором окиси серебра происходит выделение металлического серебра, осаждающегося в виде зеркала по стенкам сосуда; амальгама натрия, действуя на водный раствор альдегида, дает этиловый спирт, происходящий на счет присоединения к альдегиду двух паев водорода.С аммиаком, а также с кислыми сернистокислыми щелочами альдегид дает кристаллические соединения. При действии хлора на воду, содержащую альдегид, происходит хлоралгидрат (см. это сл.). Если через алкогольный раствор альдегидаммиака пропускать сероводород, то при этом выделяются крупные кристаллы миалдина C6H13NS2. Одно из самых интереснейших превращений альдегида — это способность его к уплотнению под влиянием многих реактивов. Так, многие минеральные кислоты, взятые даже в весьма малых количествах, напр. капля крепкой серной кислоты, довольно быстро превращают его в жидкий паральдегид, кипящ. при 123° и имеющий утроенную частицу, т. е. С6H12О3; если действие энергичной кислоты совершается на холоде, то появляются кристаллы твердого полимера альдегида, называемого метальдегидом. Как паральдегид, так и метальдегид характеризуются тем отличительным свойством, что уже при нагревании они вновь переходят, хотя и не сполна, в простое мономерное состояние альдегида. Почти при тех же условиях наряду с указанными полимерами образуются также продукты совсем иного характера, неспособные уже обратно переходить в альдегид; из них наибольшего интереса заслуживает алдоль, иначе альдегид оксимасляной кислоты С4Н8О2, по своему частичному составу как бы удвоенный уксусный альдегид, но уже представляющийся производным веществом с 4-мя паями углерода, взаимно и прочно соединенными друг с другом (см. Алдоль); чаще вместо алдоля образуется кротоновый альдегид С4Н6О, происходящий из первого выделением элементов воды. В технике альдегид употребляется при серебрении стекол и при производстве серебряных зеркал. Если, например, нагреть водный раствор альдегида с азотнокислым серебром и небольш. колич. нашатырного спирта, то стенки сосуда или стеклянная пластинка, помещенная на поверхности жидкости, быстро покрываются блестящим серебристым зеркалом. Кроме того, альдегид идет в технику для приготовления зеленой и фиолетовой анилиновой краски, а также как примесь к фруктовым эссенциям. Вследствие способности альдегида превращаться под влиянием кислорода в уксусную кислоту предлагали употреблять его для сохранения мяса и других питательных веществ.
АЛЬДЕГИДАММИАК →← АЛЬДЕГИД
Справочник содержит названия веществ и описания химических формул (в т.ч. структурные формулы и скелетные формулы).
Ацетальдегид
Брутто-формула:
C2H4O
CAS# 75-07-0
Названия
Русский:
- Ацетальдегид(IUPAC) [Wiki]
- метилформальдегид
- уксусный альдегид
- этаналь
English:
- Acetaldehyd
- Acetaldehyde(IUPAC)(CAS) [Wiki]
- Acetic Aldehyde
- Acetic ethanol
- Acetylaldehyde
- Ethyl Aldehyde
- aldehyde
- ethaldehyde
- ethanal(IUPAC)
Варианты формулы:
Реакции, в которых участвует Ацетальдегид
-
H2O + HC%CH -> /`|O|H
-
{R}/`|O|H + 2[Ag(NH3)2]OH -> 2Ag»|v» + {R}/`|O|OH + 4NH3 + H2O
, где R =
H H3C H3C HO/<`|wOH><|dOH>/<`|dOH><|dOH> -
2H3C/`|O|H + O2 -> 2H3C/`|O|OH
-
H3C-C<`|$itemColor1(blue)H><|H>-O$itemColor1(blue)H + CuO «T»-> CH3-C<//O>H + Cu + $itemColor1(blue)H2O
-
H3C/`|O|H + 3H/`|O|H «Ca(OH)2»—> O\-<`|/OH><|`/HO>-OH
|
||
|
||
| Names | ||
|---|---|---|
| Preferred IUPAC name
Acetaldehyde[3] |
||
| Systematic IUPAC name
Ethanal[3] |
||
| Other names
Acetic aldehyde |
||
| Identifiers | ||
|
CAS Number |
|
|
|
3D model (JSmol) |
|
|
| ChEBI |
|
|
| ChEMBL |
|
|
| ChemSpider |
|
|
| ECHA InfoCard | 100.000.761 |
|
| EC Number |
|
|
|
IUPHAR/BPS |
|
|
| KEGG |
|
|
|
PubChem CID |
|
|
| RTECS number |
|
|
| UNII |
|
|
|
CompTox Dashboard (EPA) |
|
|
|
InChI
|
||
|
SMILES
|
||
| Properties | ||
|
Chemical formula |
C2H4O | |
| Molar mass | 44.053 g·mol−1 | |
| Appearance | Colourless gas or liquid | |
| Odor | Ethereal | |
| Density | 0.784 g·cm−3 (20 °C)[4]
0.7904–0.7928 g·cm−3 (10 °C)[4] |
|
| Melting point | −123.37 °C (−190.07 °F; 149.78 K) | |
| Boiling point | 20.2 °C (68.4 °F; 293.3 K) | |
|
Solubility in water |
miscible | |
| Solubility | miscible with ethanol, ether, benzene, toluene, xylene, turpentine, acetone slightly soluble in chloroform |
|
| log P | -0.34 | |
| Vapor pressure | 740 mmHg (20 °C)[5] | |
| Acidity (pKa) | 13.57 (25 °C, H2O)[6] | |
|
Magnetic susceptibility (χ) |
-.5153−6 cm3/g | |
|
Refractive index (nD) |
1.3316 | |
| Viscosity | 0.21 mPa-s at 20 °C (0.253 mPa-s at 9.5 °C)[7] | |
| Structure | ||
|
Molecular shape |
trigonal planar (sp2) at C1 tetrahedral (sp3) at C2 |
|
|
Dipole moment |
2.7 D | |
| Thermochemistry[8] | ||
|
Heat capacity (C) |
89 J·mol−1·K−1 | |
|
Std molar |
160.2 J·mol−1·K−1 | |
|
Std enthalpy of |
−192.2 kJ·mol−1 | |
|
Gibbs free energy (ΔfG⦵) |
-127.6 kJ·mol−1 | |
| Hazards | ||
| Occupational safety and health (OHS/OSH): | ||
|
Main hazards |
potential occupational carcinogen[10] | |
| GHS labelling: | ||
|
Pictograms |
   [9] [9]
|
|
|
Hazard statements |
H224, H319, H335, H351[9] | |
|
Precautionary statements |
P210, P261, P281, P305+P351+P338[9] | |
| NFPA 704 (fire diamond) |
3 4 3 |
|
| Flash point | −39.00 °C; −38.20 °F; 234.15 K | |
|
Autoignition |
175.00 °C; 347.00 °F; 448.15 K[5] | |
| Explosive limits | 4.0–60% | |
| Lethal dose or concentration (LD, LC): | ||
|
LD50 (median dose) |
1930 mg/kg (rat, oral) | |
|
LC50 (median concentration) |
13,000 ppm (rat), 17,000 ppm (hamster), 20,000 ppm (rat)[10] |
|
| NIOSH (US health exposure limits): | ||
|
PEL (Permissible) |
200 ppm (360 mg/m3)[5] | |
|
IDLH (Immediate danger) |
2000 ppm[5][10] | |
| Safety data sheet (SDS) | HMDB | |
| Related compounds | ||
|
Related aldehydes |
Formaldehyde Propionaldehyde |
|
|
Related compounds |
Ethylene oxide | |
| Supplementary data page | ||
| Acetaldehyde (data page) | ||
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Acetaldehyde (IUPAC systematic name ethanal) is an organic chemical compound with the formula CH3CHO, sometimes abbreviated by chemists as MeCHO (Me = methyl). It is a colorless liquid or gas, boiling near room temperature. It is one of the most important aldehydes, occurring widely in nature and being produced on a large scale in industry. Acetaldehyde occurs naturally in coffee, bread, and ripe fruit,[11] and is produced by plants. It is also produced by the partial oxidation of ethanol by the liver enzyme alcohol dehydrogenase and is a contributing cause of hangover after alcohol consumption. Pathways of exposure include air, water, land, or groundwater, as well as drink and smoke.[12] Consumption of disulfiram inhibits acetaldehyde dehydrogenase, the enzyme responsible for the metabolism of acetaldehyde, thereby causing it to build up in the body.
The International Agency for Research on Cancer (IARC) has listed acetaldehyde as a Group 1 carcinogen.[13] Acetaldehyde is «one of the most frequently found air toxins with cancer risk greater than one in a million».[14]
History[edit]
Acetaldehyde was first observed by the Swedish pharmacist/chemist Carl Wilhelm Scheele (1774);[15] it was then investigated by the French chemists Antoine François, comte de Fourcroy and Louis Nicolas Vauquelin (1800),[16] and the German chemists Johann Wolfgang Döbereiner (1821, 1822, 1832)[17] and Justus von Liebig (1835).[18][19] In 1835, Liebig named it «aldehyde»;[20] the name was later altered to «acetaldehyde».[21]
Production[edit]
In 2003, global production was about 1 million tonnes. Before 1962, ethanol and acetylene were the major sources of acetaldehyde. Since then, ethylene is the dominant feedstock.[22]
The main method of production is the oxidation of ethylene by the Wacker process, which involves oxidation of ethylene using a homogeneous palladium/copper system:
In the 1970s, the world capacity of the Wacker-Hoechst direct oxidation process exceeded 2 million tonnes annually.
Smaller quantities can be prepared by the partial oxidation of ethanol in an exothermic reaction. This process typically is conducted over a silver catalyst at about 500–650 °C.[22]
This method is one of the oldest routes for the industrial preparation of acetaldehyde.
Other methods[edit]
Hydration of acetylene[edit]
Prior to the Wacker process and the availability of cheap ethylene, acetaldehyde was produced by the hydration of acetylene.[23] This reaction is catalyzed by mercury(II) salts:
The mechanism involves the intermediacy of vinyl alcohol, which tautomerizes to acetaldehyde. The reaction is conducted at 90–95 °C, and the acetaldehyde formed is separated from water and mercury and cooled to 25–30 °C. In the wet oxidation process, iron(III) sulfate is used to reoxidize the mercury back to the mercury(II) salt. The resulting iron(II) sulfate is oxidized in a separate reactor with nitric acid.[22]
Dehydrogenation of ethanol[edit]
Traditionally, acetaldehyde was produced by the partial dehydrogenation of ethanol:
In this endothermic process, ethanol vapor is passed at 260–290 °C over a copper-based catalyst. The process was once attractive because of the value of the hydrogen coproduct,[22] but in modern times is not economically viable.
Hydroformylation of methanol[edit]
The hydroformylation of methanol with catalysts like cobalt, nickel, or iron salts also produces acetaldehyde, although this process is of no industrial importance. Similarly noncompetitive, acetaldehyde arises from synthesis gas with modest selectivity.[22]
Reactions[edit]
Tautomerization of acetaldehyde to vinyl alcohol[edit]
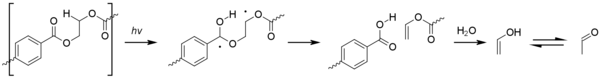
Tautomeric equilibrium between acetaldehyde and vinyl alcohol.
Like many other carbonyl compounds, acetaldehyde tautomerizes to give an enol (vinyl alcohol; IUPAC name: ethenol):
- CH3CH=O ⇌ CH2=CHOH ∆H298,g = +42.7 kJ/mol
The equilibrium constant is 6×10−7 at room temperature, thus that the relative amount of the enol form in a sample of acetaldehyde is very small.[24] At room temperature, acetaldehyde (CH3CH=O) is more stable than vinyl alcohol (CH2=CHOH) by 42.7 kJ/mol:[25] Overall the keto-enol tautomerization occurs slowly but is catalyzed by acids.
Photo-induced keto-enol tautomerization is viable under atmospheric or stratospheric conditions. This photo-tautomerization is relevant to the earth’s atmosphere, because vinyl alcohol is thought to be a precursor to carboxylic acids in the atmosphere.[26][27]
Condensation reactions[edit]
Acetaldehyde is a common electrophile in organic synthesis.[28] In condensation reactions, acetaldehyde is prochiral. It is used primarily as a source of the «CH3C+H(OH)» synthon in aldol and related condensation reactions.[29] Grignard reagents and organolithium compounds react with MeCHO to give hydroxyethyl derivatives.[30] In one of the more spectacular condensation reactions, three equivalents of formaldehyde add to MeCHO to give pentaerythritol, C(CH2OH)4.[31]
In a Strecker reaction, acetaldehyde condenses with cyanide and ammonia to give, after hydrolysis, the amino acid alanine.[32] Acetaldehyde can condense with amines to yield imines; for example, with cyclohexylamine to give N-ethylidenecyclohexylamine. These imines can be used to direct subsequent reactions like an aldol condensation.[33]
It is also a building block in the synthesis of heterocyclic compounds. In one example, it converts, upon treatment with ammonia, to 5-ethyl-2-methylpyridine («aldehyde-collidine»).[34]
Polymeric forms[edit]
Three molecules of acetaldehyde condense to form «paraldehyde», a cyclic trimer containing C-O single bonds. Similarly condensation of four molecules of acetaldehyde give the cyclic molecule metaldehyde. Paraldehyde can be produced in good yields, using a sulfuric acid catalyst. Metaldehyde is only obtained in a few percent yield and with cooling, often using HBr rather than H2SO4 as the catalyst. At -40 °C in the presence of acid catalysts, polyacetaldehyde is produced.[22] There are two stereomers of paraldehyde and four of metaldehyde.
The German chemist Valentin Hermann Weidenbusch (1821–1893) synthesized paraldehyde in 1848 by treating acetaldehyde with acid (either sulfuric or nitric acid) and cooling to 0°C. He found it quite remarkable that when paraldehyde was heated with a trace of the same acid, the reaction went the other way, recreating acetaldehyde.[35]
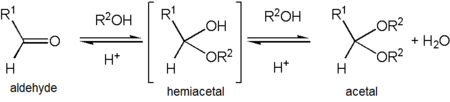
Acetal derivatives[edit]
Acetaldehyde forms a stable acetal upon reaction with ethanol under conditions that favor dehydration. The product, CH3CH(OCH2CH3)2, is formally named 1,1-diethoxyethane but is commonly referred to as «acetal».[36] This can cause confusion as «acetal» is more commonly used to describe compounds with the functional groups RCH(OR’)2 or RR’C(OR»)2 rather than referring to this specific compound – in fact, 1,1-diethoxyethane is also described as the diethyl acetal of acetaldehyde.
Precursor to vinylphosphonic acid[edit]
Acetaldehyde is a precursor to vinylphosphonic acid, which is used to make adhesives and ion conductive membranes. The synthesis sequence begins with a reaction with phosphorus trichloride:[37]
- PCl3 + CH3CHO → CH3CH(O−)PCl3+
- CH3CH(O−)PCl3+ + 2 CH3CO2H → CH3CH(Cl)PO(OH)2 + 2 CH3COCl
- CH3CH(Cl)PO(OH)2 → CH2=CHPO(OH)2 + HCl
Biochemistry[edit]
In the liver, the enzyme alcohol dehydrogenase oxidizes ethanol into acetaldehyde, which is then further oxidized into harmless acetic acid by acetaldehyde dehydrogenase. These two oxidation reactions are coupled with the reduction of NAD+ to NADH.[38] In the brain, the enzyme catalase is primarily responsible for oxidizing ethanol to acetaldehyde, and alcohol dehydrogenase plays a minor role.[38] The last steps of alcoholic fermentation in bacteria, plants, and yeast involve the conversion of pyruvate into acetaldehyde and carbon dioxide by the enzyme pyruvate decarboxylase, followed by the conversion of acetaldehyde into ethanol. The latter reaction is again catalyzed by an alcohol dehydrogenase, now operating in the opposite direction.
Uses[edit]
Traditionally, acetaldehyde was mainly used as a precursor to acetic acid. This application has declined because acetic acid is produced more efficiently from methanol by the Monsanto and Cativa processes. Acetaldehyde is an important precursor to pyridine derivatives, pentaerythritol, and crotonaldehyde. Urea and acetaldehyde combine to give a useful resin. Acetic anhydride reacts with acetaldehyde to give ethylidene diacetate, a precursor to vinyl acetate, which is used to produce polyvinyl acetate.[22]
The global market for acetaldehyde is declining. Demand has been impacted by changes in the production of plasticizer alcohols, which has shifted because n-butyraldehyde is less often produced from acetaldehyde, instead being generated by hydroformylation of propylene. Likewise, acetic acid, once produced from acetaldehyde, is made predominantly by the lower-cost methanol carbonylation process.[39] The impact on demand has led to increase in prices and thus slowdown in the market.
Production of Acetaldehyde
Consumption of acetaldehyde (103 t) in 2003[22]
(* Included in others -glyoxal/glyoxalic acid, crotonaldehyde, lactic acid, n-butanol, 2-ethylhexanol)
| Product | USA | Mexico | W. Europe | Japan | Total |
|---|---|---|---|---|---|
| Acetic Acid/Acetic anhydride | — | 11 | 89 | 47 | 147 |
| Acetate esters | 35 | 8 | 54 | 224 | 321 |
| Pentaerythritol | 26 | – | 43 | 11 | 80 |
| Pyridine and pyridine bases | 73 | – | 10 | * | 83 |
| Peracetic acid | 23 | – | – | * | 23 |
| 1,3-Butylene glycol | 14 | – | – | * | 14 |
| Others | 5 | 3 | 10 | 80 | 98 |
| Total | 176 | 22 | 206 | 362 | 766 |
China is the largest consumer of acetaldehyde in the world, accounting for almost half of global consumption in 2012. Major use has been the production of acetic acid. Other uses such as pyridines and pentaerythritol are expected to grow faster than acetic acid, but the volumes are not large enough to offset the decline in acetic acid. As a consequence, overall acetaldehyde consumption in China may grow slightly at 1.6% per year through 2018. Western Europe is the second-largest consumer of acetaldehyde worldwide, accounting for 20% of world consumption in 2012. As with China, the Western European acetaldehyde market is expected to increase only very slightly at 1% per year during 2012–2018. However, Japan could emerge as a potential consumer for acetaldehyde in next five years due to newfound use in commercial production of butadiene. The supply of butadiene has been volatile in Japan and the rest of Asia. This should provide the much needed boost to the flat market, as of 2013.[40]
Safety[edit]
Exposure limits[edit]
The threshold limit value is 25ppm (STEL/ceiling value) and the MAK (Maximum Workplace Concentration) is 50 ppm. At 50 ppm acetaldehyde, no irritation or local tissue damage in the nasal mucosa is observed. When taken up by the organism, acetaldehyde is metabolized rapidly in the liver to acetic acid. Only a small proportion is exhaled unchanged. After intravenous injection, the half-life in the blood is approximately 90 seconds.[22]
Dangers[edit]
Toxicity[edit]
Many serious cases of acute intoxication have been recorded.[22] Acetaldehyde naturally breaks down in the human body.[12][41]
Irritation[edit]
Acetaldehyde is an irritant of the skin, eyes, mucous membranes, throat, and respiratory tract. This occurs at concentrations as low as 1000 ppm. Symptoms of exposure to this compound include nausea, vomiting, and headache. These symptoms may not happen immediately. The perception threshold for acetaldehyde in air is in the range between 0.07 and 0.25 ppm.[22] At such concentrations, the fruity odor of acetaldehyde is apparent. Conjunctival irritations have been observed after a 15-minute exposure to concentrations of 25 and 50 ppm, but transient conjunctivitis and irritation of the respiratory tract have been reported after exposure to 200 ppm acetaldehyde for 15 minutes.
Carcinogenicity[edit]
Acetaldehyde is carcinogenic in humans.[42][43] In 1988 the International Agency for Research on Cancer stated, «There is sufficient evidence for the carcinogenicity of acetaldehyde (the major metabolite of ethanol) in experimental animals.»[44] In October 2009 the International Agency for Research on Cancer updated the classification of acetaldehyde stating that acetaldehyde included in and generated endogenously from alcoholic beverages is a Group I human carcinogen.[45] In addition, acetaldehyde is damaging to DNA[46] and causes abnormal muscle development as it binds to proteins.[47]
DNA crosslinks[edit]
Acetaldehyde induces DNA interstrand crosslinks, a form of DNA damage. These can be repaired by either of two replication-coupled DNA repair pathways.[48] The first is referred to as the FA pathway, because it employs gene products defective in Fanconi’s anemia patients. This repair pathway results in increased mutation frequency and altered mutational spectrum.[48] The second repair pathway requires replication fork convergence, breakage of the acetaldehyde crosslink, translesion synthesis by a Y-family DNA polymerase and homologous recombination.[48]
Aggravating factors[edit]
Alzheimer’s disease[edit]
People with a genetic deficiency for the enzyme responsible for the conversion of acetaldehyde into acetic acid may have a greater risk of Alzheimer’s disease. «These results indicate that the ALDH2 deficiency is a risk factor for LOAD [late-onset Alzheimer’s disease] …»[49]
Genetic conditions[edit]
A study of 818 heavy drinkers found that those exposed to more acetaldehyde than normal through a genetic variant of the gene encoding for alcohol dehydrogenase are at greater risk of developing cancers of the upper gastrointestinal tract and liver.[50]
Disulfiram[edit]
The drug disulfiram (Antabuse) inhibits acetaldehyde dehydrogenase, an enzyme that oxidizes the compound into acetic acid. Metabolism of ethanol forms acetaldehyde before acetaldehyde dehydrogenase forms acetic acid, but with the enzyme inhibited, acetaldehyde accumulates. If one consumes ethanol while taking disulfiram, the hangover effect of ethanol is felt more rapidly and intensely. As such, disulfiram is sometimes used as a deterrent for alcoholics wishing to stay sober.
Sources of exposure[edit]
Indoor air[edit]
Acetaldehyde is a potential contaminant in workplace, indoors, and ambient environments. Moreover, the majority of humans spend more than 90% of their time in indoor environments, increasing any exposure and the risk to human health.[51]
In a study in France, the mean indoor concentration of acetaldehydes measured in 16 homes was approximately seven times higher than the outside acetaldehyde concentration. The living room had a mean of 18.1±17.5 μg m−3 and the bedroom was 18.2±16.9 μg m−3, whereas the outdoor air had a mean concentration of 2.3±2.6 μg m−3.[citation needed]
It has been concluded that volatile organic compounds (VOC) such as benzene, formaldehyde, acetaldehyde, toluene, and xylenes have to be considered priority pollutants with respect to their health effects. It has been pointed that in renovated or completely new buildings, the VOCs concentration levels are often several orders of magnitude higher. The main sources of acetaldehydes in homes include building materials, laminate, PVC flooring, varnished wood flooring, and varnished cork/pine flooring (found in the varnish, not the wood). It is also found in plastics, oil-based and water-based paints, in composite wood ceilings, particle-board, plywood, treated pine wood, and laminated chipboard furniture.[52]
Outdoor air[edit]
The use of acetaldehyde is widespread in different industries, and it may be released into waste water or the air during production, use, transportation and storage. Sources of acetaldehyde include fuel combustion emissions from stationary internal combustion engines and power plants that burn fossil fuels, wood, or trash, oil and gas extraction, refineries, cement kilns, lumber and wood mills and paper mills.[53] Acetaldehyde is also present in automobile and diesel exhaust.[54] As a result, acetaldehyde is «one of the most frequently found air toxics with cancer risk greater than one in a million».[14]
Tobacco smoke[edit]
Natural tobacco polysaccharides, including cellulose, have been shown to be the primary precursors making acetaldehyde a significant constituent of tobacco smoke.[55][56] It has been demonstrated to have a synergistic effect with nicotine in rodent studies of addiction.[57][58] Acetaldehyde is also the most abundant carcinogen in tobacco smoke; it is dissolved into the saliva while smoking.
Cannabis smoke[edit]
Acetaldehyde has been found in cannabis smoke. This finding emerged through the use of new chemical techniques that demonstrated the acetaldehyde present was causing DNA damage in laboratory settings.[59]
Alcohol consumption[edit]
Many microbes produce acetaldehyde from ethanol, but they have a lower capacity to eliminate the acetaldehyde, which can lead to the accumulation of acetaldehyde in saliva, stomach acid, and intestinal contents. Fermented food and many alcoholic beverages can also contain significant amounts of acetaldehyde. Acetaldehyde, derived from mucosal or microbial oxidation of ethanol, tobacco smoke, and diet, appears to act as a cumulative carcinogen in the upper digestive tract of humans.[60] According to European Commission’s Scientific Committee on Consumer Safety’s (SCCS) «Opinion on Acetaldehyde» (2012) the cosmetic products special risk limit is 5 mg/L and acetaldehyde should not be used in mouth-washing products.[61]
Plastics[edit]
Acetaldehyde can be produced by the photo-oxidation of polyethylene terephthalate (PET), via a Type II Norrish reaction.[62]
Although the levels produced by this process are minute acetaldehyde has an exceedingly low taste/odor threshold of around 20–40 ppb and can cause an off-taste in bottled water.[63] The level at which an average consumer could detect acetaldehyde is still considerably lower than any toxicity.[64]
Candida Overgrowth[edit]
Candida albicans in patients with potentially carcinogenic oral diseases has been shown to produce acetaldehyde in quantities sufficient to cause problems.[65]
See also[edit]
- Alcohol dehydrogenase
- Disulfiram-like drug
- Formaldehyde
- Paraldehyde
- Wine fault
References[edit]
- ^ SciFinderScholar (accessed 4 November 2009). Acetaldehyde (75-07-0) Substance Detail.
- ^ Molecular Pathology and Diagnostics of Cancer p. 190
- ^ a b Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. 2014. p. 908. doi:10.1039/9781849733069-00648. ISBN 978-0-85404-182-4.
- ^ a b Stoffdaten Acetaldehyd bei Celanese Chemicals. Archived 17 May 2008 at the Wayback Machine as of December 1999.
- ^ a b c d NIOSH Pocket Guide to Chemical Hazards. «#0001». National Institute for Occupational Safety and Health (NIOSH).
- ^ Haynes, William M., ed. (2016). CRC Handbook of Chemistry and Physics (97th ed.). CRC Press. pp. 5–88. ISBN 9781498754293.
- ^ «Acetaldehyde».
- ^ John Rumble (18 June 2018). CRC Handbook of Chemistry and Physics (99th ed.). CRC Press. pp. 5–3. ISBN 978-1138561632.
- ^ a b c Sigma-Aldrich Co., Acetaldehyde. Retrieved on 2022-02-15.
- ^ a b c «Acetaldehyde». NIOSH. 4 December 2014. Retrieved 12 February 2015.
- ^ Uebelacker, Michael; Lachenmeier, Dirk (13 June 2011). «Quantitative Determination of Acetaldehyde in Foods Using Automated Digestion with Simulated Gastric Fluid Followed by Headspace Gas Chromatography». Journal of Automated Methods and Management in Chemistry. 2011: 907317. doi:10.1155/2011/907317. PMC 3124883. PMID 21747735.
- ^ a b «Chemicals in the Environment: Acetaldehyde (CAS NO. 75-07-0)». epa.gov. Office of Pollution Prevention and Toxics, United States Environmental Protection Agency. August 1994. Archived from the original on 17 August 2002. Retrieved 22 January 2011.
- ^ List of IARC Group 1 carcinogens
- ^ a b Zhou, Ying; Li, Chaoyang; Huijbregts, Mark A. J.; Mumtaz, M. Moiz (7 October 2015). «Carcinogenic Air Toxics Exposure and Their Cancer-Related Health Impacts in the United States». PLOS ONE. 10 (10): e0140013. Bibcode:2015PLoSO..1040013Z. doi:10.1371/journal.pone.0140013. PMC 4596837. PMID 26444872.
- ^ Scheele, C. W. (1774) «Om Brunsten eller Magnesia nigra och dess egenskaper» (On brown-stone or black magnesia [i.e., manganese ore] and its properties), Kungliga Svenska vetenskapsakademiens handlingar (Proceedings of the Royal Swedish Academy of Sciences), 35 : 89–116; 177–194. On pages 109–110, Scheele mentions that refluxing («digesting») ethanol (Alkohol vini) with manganese dioxide (Brunsten) and either hydrochloric acid (Spirtus salis) or sulfuric acid (Spiritus Vitrioli) produces a smell like «Aether nitri» (ethanol treated with nitric acid). Later investigators realized that Scheele had produced acetaldehyde.
- ^ Note:
- Dabit, a pharmacist in Nantes, France, performed a series of experiments and concluded that acetaldehyde was formed when hydrogen in ethanol combined with oxygen in sulfuric acid to form water: Dabit (1800) «Extrait du mémoire du cit. Dabit sur l’éther» (Extract of the memoir by citizen Dabit on ether), Annales de Chimie, 34 : 289–305.
- Fourcroy and Vauquelin stated that sulfuric acid was not consumed in the production of acetaldehyde: Fourcroy and Vauquelin (1800), «Sur l’éther préparé à la manière du cit. Dabit» (On the ether prepared in the way of citizen Dabit), Annales de Chimie, 34 : 318-332.
- ^ See:
- (Döbereiner) (1821) «Neue Aether» (A new ether), Journal für Chemie und Physik, 32 : 269–270. Döbereiner named the new «ether» «Sauerstoffäther» (oxygen-ether).
- (Döbereiner) (1822) «Döbereiner’s Apparat zur Darstellung des Sauerstoffaethers» (Döbereiner’s apparatus for the preparation of oxygen-ether), Journal für Chemie und Physik, 34 : 124–125.
- Döbereiner, J. W. (1832) «Bildung des Sauerstoff-Aethers durch atmosphärische Oxidation des Alkohols» (Formation of oxy-ether by atmospheric oxidation of alcohol), Journal für Chemie und Physik, 64 : 466–468. In this paper, Döbereiner made acetaldehyde by exposing ethanol vapor to air in the presence of platinum black.
- ^ Liebig, Justus (1835) «Ueber die Producte der Oxydation des Alkohols» (On the products of oxidation of alcohol [i.e., ethanol]), Annalen der Chemie, 14 : 133–167.
- ^ Brock, William H. (1997) Justus von Liebig: The Chemical Gatekeeper. Cambridge, England: Cambridge University Press, pp. 83–84.
- ^ Liebig, J. (1835) «Sur les produits de l’oxidation de l’alcool» (On the products of the oxidation of alcohol), Annales de Chimie et de Physique, 59 : 289–327. From p. 290: «Je le décrirai dans ce mémoire sous le nom d’aldehyde; ce nom est formé de alcool dehydrogenatus.» (I will describe it in this memoir by the name of aldehyde; this name is formed from alcohol dehydrogenatus.)
- ^ The name change occurred at least as early as 1868. See, for example: Eugen F. von Gorup-Besanez, ed., Lehrbuch der organischen Chemie für den Unterricht auf Universitäten … [Textbook of Organic Chemistry for Instruction at Universities …], 3rd ed. (Braunschweig, Germany: Friedrich Vieweg und Sohn, 1868), vol. 2, p. 88.
- ^ a b c d e f g h i j k Eckert, Marc et al. (2007) «Acetaldehyde» in Ullmann’s Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim. doi:10.1002/14356007.a01_031.pub2
- ^ Dmitry A. Ponomarev; Sergey M. Shevchenko (2007). «Hydration of Acetylene: A 125th Anniversary» (PDF). J. Chem. Educ. 84 (10): 1725. Bibcode:2007JChEd..84.1725P. doi:10.1021/ed084p1725.
- ^ Keeffe, J. R.; Kresge, A. J.; Schepp, N. P. (1990). «Keto-enol equilibrium constants of simple monofunctional aldehydes and ketones in aqueous solution». Journal of the American Chemical Society. 112 (12): 4862–4868. doi:10.1021/ja00168a035.
- ^ Johnson, R.D. III «CCCBDB NIST Standard Reference Database». nist.gov
- ^ Heazlewood, B. R.; MacCarone, A. T.; Andrews, D. U.; Osborn, D. L.; Harding, L. B.; Klippenstein, S. J.; Jordan, M. J. T.; Kable, S. H. (2011). «Near-threshold H/D exchange in CD3CHO photodissociation». Nature Chemistry. 3 (6): 443–8. Bibcode:2011NatCh…3..443H. doi:10.1038/nchem.1052. PMID 21602858.
- ^ Andrews, D. U.; Heazlewood, B. R.; MacCarone, A. T.; Conroy, T.; Payne, R. J.; Jordan, M. J. T.; Kable, S. H. (2012). «Photo-Tautomerization of Acetaldehyde to Vinyl Alcohol: A Potential Route to Tropospheric Acids». Science. 337 (6099): 1203–6. Bibcode:2012Sci…337.1203A. doi:10.1126/science.1220712. PMID 22903524. S2CID 42079807.
- ^ Sowin, T. J.; Melcher, L. M. (2004) «Acetaldehyde» in Encyclopedia of Reagents for Organic Synthesis (Ed: L. Paquette), J. Wiley & Sons, New York. doi:10.1002/047084289X
- ^ Behrens, C.; Paquette, L. A. (1998). «N-Benzyl-2,3-Azetidinedione (2,3-Azetidinedione, 1-(phenylmethyl)-)». Organic Syntheses. 75: 106. doi:10.15227/orgsyn.075.0106.; Collective Volume, vol. 10, p. 41.
- ^ Walter, L. A. (1943). «1-(α-Pyridyl)-2-Propanol (2-(β-Hydroxypropyl)pyridine)». Organic Syntheses. 23: 83. doi:10.15227/orgsyn.023.0083.; Collective Volume, vol. 3, p. 757
- ^ Schurink, H. B. J. (1925). «Pentaerythritol». Organic Syntheses. 4: 53. doi:10.15227/orgsyn.004.0053.; Collective Volume, vol. 1, p. 425
- ^ Kendall, E. C.; McKenzie, B. F. (1929). «dl-Alanine». Organic Syntheses. 9: 4. doi:10.15227/orgsyn.009.0004.; Collective Volume, vol. 1, p. 21
- ^ Wittig, G.; Hesse, A. (1970). «Directed Aldol Condensations: β-Phenylcinnamaldehyde (2-Propenal, 3,3-diphenyl-)». Organic Syntheses. 50: 66. doi:10.15227/orgsyn.050.0066.; Collective Volume, vol. 6, p. 901
- ^ Frank, R. L.; Pilgrim, F. J.; Riener, E. F. (1950). «5-Ethyl-2-Methylpyridine (2-Picoline, 5-ethyl-)». Organic Syntheses. 30: 41. doi:10.15227/orgsyn.030.0041.
- ^ Weidenbusch, H. (1848) «Ueber einige Producte der Einwirkung von Alkalien und Säuren auf den Aldehyd» (On some products of the reaction of alkalies and acids with acetaldehyde), Annalen der Chemie, 66 : 152-165; see pp. 155–158.
- ^ Adkins, H.; Nissen, B. H. (1923). «Acetal». Organic Syntheses. 3: 1. doi:10.15227/orgsyn.003.0001.; Collective Volume, vol. 1, p. 1
- ^ Lavinia, M.; Gheorghe, I. (2010). «Poly(vinylphosphonic acid) and its derivatives». Progress in Polymer Science. 35 (8): 1078–1092. doi:10.1016/j.progpolymsci.2010.04.001.
- ^ a b Hipolito, L.; Sanchez, M. J.; Polache, A.; Granero, L. (2007). «Brain metabolism of ethanol and alcoholism: An update». Curr. Drug Metab. 8 (7): 716–727. doi:10.2174/138920007782109797. PMID 17979660.
- ^ «Acetaldehyde». ihs.com.
- ^ Research and Markets ltd. «Acetaldehyde – Global Business Strategic Report».
- ^ Tsukamoto, S; Muto, T; Nagoya, T; Shimamura, M; Saito, M; Tainaka, H (1989). «Determinations of ethanol, acetaldehyde and acetate in blood and urine during alcohol oxidation in man». Alcohol and Alcoholism. 24 (2): 101–8. doi:10.1093/oxfordjournals.alcalc.a044872. PMID 2719768.
- ^ Chemical Summary For Acetaldehyde, US Environmental Protection Agency
- ^ Scientific Committee on Cosmetic Products and Non-Food Products (25 May 2004). «Opinion of the Scientific Committee on Cosmetic Products and Non-Food Products Intended for Consumers Concerning Acetaldehyde» (PDF). p. 11. Archived (PDF) from the original on 9 October 2022. Retrieved 28 September 2011.
- ^ International Agency for Rescarch on Cancer, World Health Organization. (1988). Alcohol drinking. Lyon: World Health Organization, International Agency for Research on Cancer. ISBN 978-92-832-1244-7. p3
- ^ International Agency for Research on Cancer Monograph Working Group, Special Report: Policy A review of human carcinogens—Part E: tobacco, areca nut, alcohol, coal smoke, and salted fish. The Lancet 2009 10, 1033–1034.
- ^ Lambert, B; He, S. M. (1988). «DNA and chromosome damage induced by acetaldehyde in human lymphocytes in vitro». Annals of the New York Academy of Sciences. 534 (1): 369–76. Bibcode:1988NYASA.534..369L. doi:10.1111/j.1749-6632.1988.tb30124.x. PMID 3389666. S2CID 22732731.
- ^ Aberle, N. S.; Burd, L; Zhao, B. H.; Ren, J (2004). «Acetaldehyde-Induced Cardiac Contractile Dysfunction May Be Alleviated by Vitamin B1 but Not by Vitamins B6 or B12». Alcohol and Alcoholism. 39 (5): 450–4. doi:10.1093/alcalc/agh085. PMID 15304379.
- ^ a b c Hodskinson MR, Bolner A, Sato K, Kamimae-Lanning AN, Rooijers K, Witte M, Mahesh M, Silhan J, Petek M, Williams DM, Kind J, Chin JW, Patel KJ, Knipscheer P. Alcohol-derived DNA crosslinks are repaired by two distinct mechanisms. Nature. 2020 Mar;579(7800):603-608. doi: 10.1038/s41586-020-2059-5. Epub 2020 Mar 4. PMID 32132710; PMCID: PMC7116288.
- ^ Ohta, S; Ohsawa I; Kamino K; Ando F; Shimokata H. (April 2004). «Mitochondrial ALDH2 Deficiency as an Oxidative Stress». Annals of the New York Academy of Sciences. 1011 (1): 36–44. Bibcode:2004NYASA1011…36O. doi:10.1196/annals.1293.004. PMID 15126281. S2CID 28571902.
- ^ Homann, N.; Stickel, F.; König, I. R.; Jacobs, A.; Junghanns, K.; Benesova, M.; Schuppan, D.; Himsel, S.; Zuber-Jerger, I.; Hellerbrand, C.; Ludwig, D.; Caselmann, W. H.; Seitz, H. K. (2006). «Alcohol dehydrogenase 1C*1 allele is a genetic marker for alcohol-associated cancer in heavy drinkers». International Journal of Cancer. 118 (8): 1998–2002. doi:10.1002/ijc.21583. PMID 16287084. S2CID 11716548.
- ^ Spengler, John D.; McCarthy, John F.; Samet, Jonathan M. (2000). Indoor Air Quality Handbook. New York, NY, USA: McGraw-Hill Professional Publishing. p. 761. ISBN 978-0074455494.
- ^ Dafni A. Missia; E. Demetriou; N. Michael; E.I. Tolis; J.G. Bartzis (2010). «Indoor exposure from building materials: A field study». Atmospheric Environment. 44 (35): 4388–4395. Bibcode:2010AtmEn..44.4388M. doi:10.1016/j.atmosenv.2010.07.049.
- ^ Shrestha, Krishna Prasad; Giri, Binod Raj; Adil, Mohammad; Seidel, Lars; Zeuch, Thomas; Farooq, Aamir; Mauss, Fabian (16 September 2021). «Detailed Chemical Kinetic Study of Acetaldehyde Oxidation and Its Interaction with NOx». Energy & Fuels. 35 (18): 14963–14983. doi:10.1021/acs.energyfuels.1c01948. hdl:10754/670859. ISSN 0887-0624. S2CID 239683740.
- ^ Clements, A. L.; Jia, Y.; Denbleyker, A.; McDonald-Buller, E.; Fraser, M. P.; Allen, D. T.; Collins, D. R.; Michel, E.; Pudota, J.; Sullivan, D.; Zhu, Y. (2009). «Air pollutant concentrations near three Texas roadways, part II: Chemical characterization and transformation of pollutants». Atmospheric Environment. 43 (30): 4523–4534. Bibcode:2009AtmEn..43.4523C. doi:10.1016/j.atmosenv.2009.06.044.
- ^ Talhout, R; Opperhuizen, A; van Amsterdam, JG (October 2007). «Role of acetaldehyde in tobacco smoke addiction». Eur Neuropsychopharmacol. 17 (10): 627–36. doi:10.1016/j.euroneuro.2007.02.013. PMID 17382522. S2CID 25866206.
- ^ Talhout, Reinskje; Schulz, Thomas; Florek, Ewa; Van Benthem, Jan; Wester, Piet; Opperhuizen, Antoon (2011). «Hazardous Compounds in Tobacco Smoke». International Journal of Environmental Research and Public Health. 8 (12): 613–628. doi:10.3390/ijerph8020613. ISSN 1660-4601. PMC 3084482. PMID 21556207.
- ^ «NIDA – Publications – NIDA Notes – Vol. 20, No. 3» Archived 25 August 2009 at the Wayback Machine. drugabuse.gov.
- ^ Nicotine’s addictive hold increases when combined with other tobacco smoke chemicals, UCI study finds. University of California. 2004-10-28
- ^ Singh, R (2009). «Evaluation of the DNA Damaging Potential of Cannabis Cigarette Smoke by the Determination of Acetaldehyde Derived N2-Ethyl-2′-deoxyguanosine Adducts». Chem. Res. Toxicol. 22 (6): 1181–1188. doi:10.1021/tx900106y. PMID 19449825.
- ^ Salaspuro, M. (2009). «Acetaldehyde as a common denominator and cumulative carcinogen in digestive tract cancers». Scandinavian Journal of Gastroenterology. 44 (8): 912–925. doi:10.1080/00365520902912563. PMID 19396661. S2CID 23291758.
- ^ Scientific Committee on Consumer Safety SCCS OPINION ON Acetaldehyde. European Commission. 18 September 2012
- ^ Day, M.; Wiles, D. M. (January 1972). «Photochemical degradation of poly(ethylene terephthalate). III. Determination of decomposition products and reaction mechanism». Journal of Applied Polymer Science. 16 (1): 203–215. doi:10.1002/app.1972.070160118.
- ^ Nawrocki, J; Dąbrowska, A; Borcz, A (November 2002). «Investigation of carbonyl compounds in bottled waters from Poland». Water Research. 36 (19): 4893–4901. doi:10.1016/S0043-1354(02)00201-4. PMID 12448533.
- ^ «Do Acetaldehyde and Formaldehyde from Pet Bottles Result in Unacceptable Flavor or Aroma in Bottled Water?» (PDF). PET Resin Association. Archived (PDF) from the original on 9 October 2022. Retrieved 26 February 2015.
- ^ Gainza-Cirauqui, M.L.; Nieminen, M.T.; Novak Frazer, L.; Aguirre-Urizar, J.M.; Moragues, M.D.; Rautemaa, R. (March 2013). «Production of carcinogenic acetaldehyde by Candida albicans from patients with potentially malignant oral mucosal disorders». Journal of Oral Pathology and Medicine. 42 (3): 243–249. doi:10.1111/j.1600-0714.2012.01203.x. PMID 22909057.
External links[edit]
- International Chemical Safety Card 0009
- NIOSH Pocket Guide to Chemical Hazards
- Methods for sampling and analysis
- IARC Monograph: «Acetaldehyde»
- Hal Kibbey, Genetic Influences on Alcohol Drinking and Alcoholism, Indiana University Research and Creative Activity, Vol. 17 no. 3.
- United States Food and Drug Administration (FDA) information for acetaldehyde
- Acetaldehyde production process flow sheet by ethylene oxidation method