Правильное написание группы крови
Что такое группа крови человека, известно каждому, но зато не каждый знает, как она обозначается, определяется и у кого какой тип плазмы. Не смотря на это, известно, что о крови знают уже достаточно давно и ее описание давно практикуется в медицине. Это касается тех случаев, когда необходима донорская плазма для реципиента и обязательная совместимость для пациентов.
Таким образом, еще с давних времен пошло понятие такое, что разделяют группы крови на специальные обозначения, что позволяет их правильно разделять и писать. В этой статье мы поговорим именно об этом, чтоб каждый смог узнать, как именно пишется та или иная группа и иметь представление о своем назначении. Знать свой тип плазмы просто необходимо, ведь в жизни случаются разные ситуации. Чаще всего это касается экстренных случаев, когда реципиенту срочно нужна плазма, а донора нет.
Если вы будете знать, какая у вас группа крови, то вряд ли вы сможете отказать. Только при этом еще стоит помнить про некоторые ограничения. Стать донором может только абсолютно здоровый человек, без хронических заболеваний и лишних пристрастий к алкогольным напиткам. В идеале перед тем, как сдавать плазму на донорство, необходимо пройти обследование, позволяющие определить, можно ли делать вам забор или нет. Ведь писать можно что угодно, а лишний раз провериться стоит обязательно.
Перед переливанием обычно проводят типирование: http://krasnayakrov.ru/analizy-krovi/vazhnost-tipirovaniya-krovi-dlya-cheloveka.html
Особенности плазмы
Ко всему тому, что кровь играет важное значение в организме человека, стоит помнить, что для правильности ее восприятия, необходимо правильно определить эту группу крови и соответственно записать. Если перепутать хоть одну букву или цифру в записи, то может получиться уже совершенно не та форма.
Теперь разберемся, что обозначает та или иная буква и цифра в записи типа и как ее писать. Вся кровь состоит из плазмы, эритроцитов, тромбоцитов и лейкоцитов. Так же есть определенные антигены, участвующие в записи группы. Чтоб было как можно лучше понятнее, представим таблицу, в которой описано отношение тех или иных антител в определенной группе крови.
| Обозначение группы | Агглютиногены, содержащиеся в эритроцитах | Агглютинины, содержащиеся в сыворотке |
| 0(I) | 0 | a и b |
| A(II) | A | b |
| B(III) | B | a |
| AB(IV) | A и B | 0 |
Данная таблица описывает обозначение определенной группы крови и отношение агглютиногенов к каждой из них. Описание проводится по специальной системе АВ0, позволяющая написать правильно тип плазмы.
Резус-фактор

Учитывался исключительно положительный и отрицательный резус-фактор. Например, если реципиенту требовалась первая положительная, то донора могли взять в первой положительной. В данном случае был важен исключительно показатель резус-фактора.
Существует предположение, что у некоторых людей возможна смена группы крови с течением жизни. Возможно ли это? Подробнее в статье: http://krasnayakrov.ru/gruppy-krovi/mozhet-li-menyatsya.html
На сегодняшний день такие переливания настрого запрещены. Это связано с тем, что участились случаи возникновения несовместимости. Поэтому при переливании учитывается строго типа плазмы и ее резус-фактор. Резус – это специальный белок, находящийся на мембране эритроцитов. Его присутствие говорит о том, что резус-фактор положительный, а отсутствие – отрицательный. В записях формы обозначения резус обозначается в виде английских букв Rh+ и Rh- — соответственно положительный и отрицательный.
Стоит отметить, что положительный резус встречается наиболее часто по сравнению с отрицательным. С чем именно это связано медики пока не могут точно сказать. Так же как и про распространенность первой и второй группы крови, ввиду того, что четвертая отрицательная встречается вообще очень редко.
Записи определенных типов
Каждую из четырех групп можно написать следующим образом:
0 (I) — 1-я группа
А (II) — 2-я группа
В (III) — 3-я группа
АВ (IV) — 4-я группа крови
Ко всему этому стоит отметить, что существует у каждого типа свой резус-фактор.
Поэтому форма пишется именно так:
0(I) Rh+, А (II) Rh+, B (III) Rh+, AB (IV) Rh+, 0(I) Rh-, А (II) Rh-, B (III) Rh-, AB (IV) Rh-.
Это говорит о том, что у каждой группы крови есть свои особые разновидности и главное их правильно написать. Каждая ошибочная буква может дорого обойтись человеку, особенно это касается резус-фактора. Одна единая палочка может перепортить человеку все, даже здоровье, ведь несовместимость серьезная вещь и ею пренебрегать ни в коем случае нельзя. Об этом как раз и поговорим далее.
Совместимости типов плазмы
Учитывая то, что кровь различается по группам и резус-фактору, имеется такое понятие, как совместимость или ее отсутствие. Ее можно писать в качестве дополнительной информации в карточке пациента или просто для себя.
В большей степени несовместимость характеризуется разными резус-факторами. Например, первую группу крови с положительным резусом можно переливать ко второй тоже с положительным. Если плазмы смешать с разными резусами, возникает несовместимость. Данное явление описывается склеиванием эритроцитов и образованием тромбоцитоза. Такое склеивание возникает потому, что существующей в крови белок не может взаимодействовать с другой, в которой этот белок отсутствует. Тоже самое может произойти при смешивании разных типов плазмы с учетом разного резуса.
Тромбоцитоз может нести угрозу здоровью человека: http://krasnayakrov.ru/organizm-cheloveka/trombotsitoz-prichinyi-i-lechenie.html
Анализ плазмы на резус является очень распространенным. Его делают обязательно в каждой больнице перед хирургическим вмешательством, чтобы избежать проблем, которые могут возникнуть при переливании крови. Этот же анализ обязателен при постановке женщин на учет по беременности. А также для всех мужчин при постановке на воинский учет. Если это не ваш случай, то узнать группу крови можно в ближайшей поликлинике. Обратитесь к вашему участковому врачу. Кровь на анализ берут из вены. Особой подготовки не требуется, разве что полное исключение медикаментозных препаратов и спиртного. Это совершено не больно и ко всему этому достаточно быстро. Уже через несколько дней будет готов ваш результат.
Так же можно заказать срочный анализ, но это будет стоит немного дороже. Знать свой тип плазмы просто необходимо, ведь в противном случае вы может очутиться в экстренной ситуации, где просто не будет времени определять дополнительно. Если вы до сих пор не знаете свой тип плазмы, сделайте анализ, чтоб в дальнейшем не было никаких лишних проблем. Тем более это еще очень полезно, если вы следите за своей фигурой и верите определению по поводу того, что правильно питаться в соответствии с типом плазмы очень даже полезно. Так же это положительно влияет на здоровье и фигуру.
- Распечатать
Как я стал врачом? Довольно-таки трудный вопрос… Если задуматься — выбора и не было. Я родился в семье врача реаниматолога, и каждый день за ужином я слышал рассказ отца о том, как же прошел его день. В детстве это всё казалось фантастичным, за гранью реальности.
Оцените статью:
- 5
- 4
- 3
- 2
- 1
(6 голосов, среднее: 4.8 из 5)
Поделитесь с друзьями!
Группа крови и резус-фактор являются постоянными признаками, которые передаются по наследству, неизменны в течение всей жизни и не могут измениться под влиянием болезней. Обладание одной из четырех групп крови определяется парой генов, пришедших по одному от каждого из родителей.
ОГЛАВЛЕНИЕ
- Группа крови и резус фактор
- Как определяют группу крови?
- Зачем нужно знать свою группу крови?
- Совместимость групп крови
- Резус-конфликт при беременности
- Какая группа крови будет у ребенка?
- Конфликт по группе крови при беременности
- Диеты по группам крови
- Характер человека по группе крови
- Группа крови и болезни
Группа крови и резус фактор
Существует несколько делений человеческой крови на группы, но наибольшее значение имеет разделение крови на четыре группы по системе «AB0» и на две — по системе «резус».
Международное обозначение группы крови — «система АВ0»:
- I (0) – первая. Эритроциты не содержат агглютиногенов, но в плазме — 2 агглютинина;
- II (А) – вторая. Присутствует агглютиноген А и агглютинин БЕТТА;
- III (В) – третья. Содержит агглютиноген В и агглютинин АЛЬФА;
- IV (АВ) – четвертая. Содержит агглютиногены А и В, агглютининов нет.
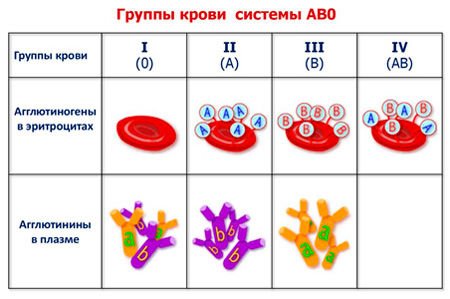
Группы крови по системе «AB0»
Система групп крови АВО открыта в начале XX века австралийским ученым К. Ландштейнером при изучении поведения эритроцитов (красных кровяных телец) в сыворотке (жидкой части) крови разных людей. Ученый обратил внимание на тот факт, что эритроциты в сыворотке крови одних людей распределяются равномерно, а других — склеиваются. Используя разные комбинации эритроцитов и сывороток, он обнаружил три группы крови (I—III), а существование IV группы (более редкой) было установлено позднее. Частота встречаемости групп крови системы АВ0 у разных национальностей различна. У русских наиболее часто встречается A(II) – 38% и 0(I) – 33%. А американские индейцы в 99-100% случаев имеют только 1 группу крови.
Группа крови АВ достаточно редка во всех частях мира, независимо от национальной и расовой принадлежности. Она не может передаваться по наследству, а формируется у плода под влиянием полученных от родителей генов – А и В.
Кровь определенного количества людей может содержать белок, получивший название резус-фактора (Rh). По резус-фактору всех людей можно разделить на резус-положительных Rh(+) и резус-отрицательных Rh(–).
Резус-система была открыта в 40-е годы XХ в. К. Ландштейнером. Изучая кровь человека и животных, ученый обнаружил, что кровь примерно 85% обследованных людей подобна крови обезьян (макак-резус).
Было доказано, что кровь этих людей содержит антиген D, идентичный имеющемуся у резуса. Обнаруженный антиген D был назван резус-фактором (Rh). Кровь таких людей называют резус-положительной Rh(+), а в которой резус-фактор отсутствует, называют резус-отрицательной Rh(–). Вскоре было показано, что присутствие или отсутствие этого гена наследуется. Наследование резус-фактора происходит независимо от наследования группы крови.
Как определяют группу крови?
Определяют группу крови с помощью цоликлонов, взяв каплю венозной крови. Название «Цоликлон» происходит от названия учреждения, где специальный солевой раствор был разработан – Центральный Ордена Ленина Институт Крови (нынешний «Национальный медицинский исследовательский центр гематологии» Министерства здравоохранения Российской Федерации.)
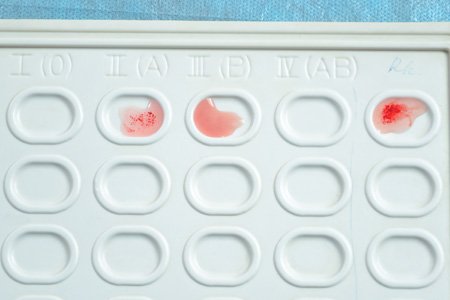
Определение группы крови.
Вторая группа крови, резус положительный
Определение группы крови цоликлонами анти-А, анти-В является наиболее современным и относительно простым методом. Наносятся цоликлоны анти-А и анти-В на специальный планшет по одной большой капле, под соответствующими надписями. Рядом с ними наносится исследуемая кровь по одной маленькой капле. После смешивания реагентов и крови медицинский работник наблюдает за наступлением или отсутствием реакции агглютинации (склеивания) в течение 3 минут.
| Реакция исследуемой крови с цоликлонами | Исследуемая кровь принадлежит к группе | |
|---|---|---|
| анти-А | анти-В | |
| – | – | 0(I) |
| + | – | A(II) |
| – | + | B(III) |
| + | + | AB(IV) |
Определение резус-фактора с помощью реагента (Цоликлон анти-D Супер). На тарелку наносят большую каплю реагента, рядом помещают маленькую каплю исследуемой крови и смешивают кровь с реагентом. Если реакция агглютинации начинает развиваться – резус положительная Rh(D)«+», нет агглютинации – резус отрицательная Rh(D)«–».
Зачем нужно знать свою группу крови?
Каждый человек должен знать свою группу крови и резус-принадлежность.
Определение трансфузионной совместимости. Группу крови необходимо знать для более быстрого подбора донора при острых кровопотерях для переливании крови.
Предоперационная подготовка. Для тяжелобольных людей, которым необходима трансплантация органов или тканей. Женщинам во время операции кесарева сечения.
Во время беременности. Наблюдение в динамике беременных с отрицательным резус-фактором, так как беременность при резус несовместимости матери и плода требует большего внимания врачей к беременной.
Диагностика гемолитической болезни новорожденных. Выявление несовместимости крови матери и плода по системе АВ0.
Совместимость групп крови
Определение группы крови необходимо для того, чтобы понимать, кровь какой группы можно, а какой нельзя переливать человеку.
Если не определена группа крови, то при её переливании от одного человека (донора) другому (реципиенту) в результате взаимодействия между эритроцитами и плазмой крови донора и реципиента может произойти склеивание эритроцитов (агглютинация) и последующее их разрушение (гемолиз).
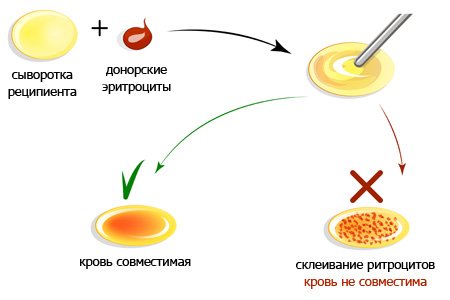
Совместимость групп крови
При переливании несовместимой крови развивается гемотрансфузионный шок, который может привести к смерти. Поэтому в настоящее время придерживаются правила, по которому переливается только одногруппная кровь.
Переливание цельной крови с учетом групп осуществляется только по принципу одноименной группы (для детей это правило является обязательным). Кровь донора 0 (I) группы можно переливать реципиенту 0 (I) группы, и так далее. В экстренных ситуациях, когда нет времени или возможности делать анализ, допустимо переливание крови I группы «отрицательной» реципиентам остальных групп («до выяснения»), так как 0 (I) группа крови является универсальной.
Вливание несовместимой крови по групповой и резус-фактор принадлежности вызывает у пациента агглютинацию (склеивание) собственных эритроцитов, что вызывает смерть. Если смешать две разные группы крови на стеклянной пластинке, реакция отторжения будет настолько сильной, что ее можно наблюдать невооруженным глазом: клетки одной группы будут связываться антигенами чужеродной крови.
Каждый из нас является потенциальным донором и человеком, которому необходимо переливание крови.
Универсальный донор – человек с группой крови I, резус-отрицательной. Частота встречаемости составляет 6,45%.
Универсальный реципиент (кому переливают) – человек с группой крови IV, резус-положительной. Частота встречаемости составляет 5,95%.
Резус-конфликт при беременности
Резус-фактор – это белок, который находится на поверхности красных кровяных телец. Если он присутствует, то это положительный резус (Rh+), если отсутствует, то отрицательный (Rh-).
Согласно статистике, около 85% людей имеют положительный резус, остальные 15% – отрицательный. Если у беременной женщины Rh-, а у супруга Rh+, то у планируемого ребенка в 50% случаев резус-фактор будет положительный (Rh+). Резус-конфликт возникает при беременности женщины с отрицательным резусом, если кровь у плода – резус-положительная.
Точно сказать, какой резус-фактор унаследует ребенок, можно только в одном случае: если у обоих родителей Rh-статус отрицательный. Все дети такой пары будут иметь резус-отрицательный фактор. Во всех остальных случаях Rh может быть любым.
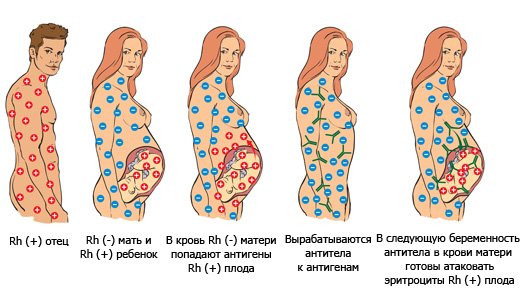
Резус-конфликт при беременности
Когда в кровь матери с отрицательным резусом попадают эритроциты резус-положительного плода, они воспринимаются ее иммунной системой как чужеродные. Организм начинает вырабатывать антитела для уничтожения эритроцитов ребенка. При этом в его крови появляется большое количество вещества, называемого билирубином, которое может повредить его мозг.
Поскольку эритроциты плода непрерывно уничтожаются, его печень и селезенка стараются ускорить выработку новых эритроцитов, увеличиваясь при этом в размерах. В конце концов, и они не справляются с восполнением убыли эритроцитов. Наступает сильное кислородное голодание, которое вызывает еще больше патологий. В самых тяжелых случаях это может привести к гибели плода.
В женской консультации беременную обязательно проверяют на резус-фактор. Если он отрицательный, необходимо определить резусную принадлежность отца. При риске резус-конфликта (если у отца Rh(+)) кровь женщины неоднократно исследуется на наличие в ней антител к эритроцитам плода и их количество.
По уровню антител в крови будущей матери врач может определить возможное начало резус-конфликта и сделать выводы о предполагаемом резус-факторе у ребенка.
При первой беременности иммунная система будущей матери только «знакомится с чужаками» (Rh+ эритроцитами), антител вырабатывается немного и конфликт может не возникнуть. Однако в организме женщины остаются «клетки памяти», которые при последующих беременностях оперативно «организуют» быструю и мощную выработку антител против резус-фактора. Следовательно, риск поражения плода при каждой следующей беременности возрастает.
Поэтому сразу после родов определяют резус-фактор у младенца. Если он положительный, то матери не позднее 72 часов после родов вводят антирезусную сыворотку (антирезусный иммуноглобулин), которая предупредит развитие резус-конфликта при следующей беременности.
Такую же профилактику антирезусной сывороткой резус-отрицательные женщины должны проводить после внематочной беременности, аборта, выкидыша.
Какая группа крови будет у ребенка?
Группа крови ребенка находится в строго определенной зависимости от групповой принадлежности крови родителей. Было доказано, что точно так же, как ребенок наследует цвет глаз, кожи, волос, таким же принципам наследования подчиняется и группа крови.
Генетическое наследование группы крови является строго закономерным. Но это не значит, что если у обоих родителей, например, вторая группа крови, то у их детей будет только вторая.
Укажите группы крови мамы и папы и вы сможете вычислить группу крови ребёнка.
Так выяснилось, что если у родителей вторая (II) и третья (III) группа крови, то их дети могут в равной степени наследовать любую группу крови. И наоборот, если у папы с мамой первая (I) и четвертая (IV), то дети наследуют группу крови, отличную от родителей – вторую (II) или третью (III). Также первая группа (I) исключена, если один из родителей имеет четвертую группу крови AB (IV).
Групповую принадлежность членов семьи учитывают в судебной медицине при проведении экспертизы при спорном отцовстве или замене детей.
Конфликт по группе крови при беременности
Помимо простого интереса «Какая группа крови будет у будущего ребенка?» существует еще одна веская причина, чтобы знать, какая группа крови может быть у вашего малыша. При беременности может возникнуть не только резус-конфликт, но в некоторых случаях и конфликт по группам крови.
Если у матери первая группа крови (I), а у ребенка любая другая, она может вырабатывать против него антитела. В данном случае необходимо проверять наличие групповых антител у женщин с первой группой крови, так как при их наличии возможно развитие гемолитической болезни новорожденного по группе крови. Однако тяжелая форма гемолитической болезни новорожденного встречается редко, лишь в единичных случаях.
Диеты по группам крови
Диета по группам крови стала набирать обороты. Такая диета представляет собой перечень рекомендуемых продуктов, которые должны входить в рацион людей с той или иной группой крови.
Первая группа крови I (0) — «Охотник». Считается, что первая группа самая древнейшая на земле, и люди с первой группой крови – мясоеды, поэтому диета их должна содержать большое количество высокопротеиновых продуктов: мясо, рыбу, овощи и фрукты, бобовые и гречку.
Ограничивать крупы, особенно овсянку, пшеницу и изделия из нее (в том числе пшеничный хлеб), избегать капусту, кукурузу, консервированный продукты. Из напитков употреблять чай и травяные сборы (ромашка, шиповник, мята), и не употреблять кофе и молочные продукты. Основными принципами сохранения хорошего здоровья для таких людей должны стать физическая нагрузка и поступление в организм большого количества белков.
Вторая группа крови — «Земледелец». Людям со второй группой рекомендовано полное вегетарианство. По возможности должны полностью исключить из своего рациона мясо и птицу, так как эти продукты плохо перевариваются и откладываются в организме в виде жира. Также употребление мяса может повысить содержание пищевых токсинов. Однако можно некоторые сорта рыбы, соевые продукты, овощи, фрукты, кисломолочные продукты. Из напитков рекомендуется пить кофе, а зеленый, черный чай и газированные напитки избегать.

Третья группа крови — «Воины». Людям с третьей группой можно употреблять в пищу практически всё: мясо, рыбу, кисломолочные продукты, яйца, крупы (кроме гречи и пшеницы), бобовые (кроме чечевицы), овощи, фрукты. Рекомендуется избегать морепродуктов (ракообразных, моллюсков, креветок, мидий, устриц), куриное мясо и свинину. Можно пить любой чай, включая травяные, кофе, различные соки, любые молочные продукты.
Четвертая группа крови — «Интеллектуалы». Им можно практически все. Однако им следует исключить из рациона красное мясо, ветчину и бекон, подсолнечные семечки, гречневую крупу, перец, пшеницу и кукурузу (то есть достаточно калорийные продукты, которые исключаются при любой диете). Для улучшения обмена веществ рекомендуется включить в свой рацион морепродукты и зеленые овощи, бурые водоросли и молочные продукты. Людям с IV группой крови желательно исключить кетчуп, маринованные и соленые приправы, уксус, пищевой желатин.
Принадлежность человека к той или иной группе крови не определяет вкусовые предпочтения, а также способность организма перерабатывать и усваивать те или иные пищевые продукты. Рекомендации по соблюдению различных диет в зависимости от группы крови не имеют под собой научного обоснования.
Если прочитать внимательно рекомендации по соблюдению диеты по группе крови, то можно обнаружить, что наряду с набором продуктов (во многом совпадающим для всех групп) авторы рекомендуют оптимальный режим труда и отдыха, отказ или сдержанное употребление алкоголя, прогулки, физические упражнения и т.п. Это основные правила здорового образа жизни, которые никак не связаны с группой крови.
Характер человека по группе крови
Считается, что кровь в большей степени определяет характер и особенности человека, чем знаки зодиака.
Многие компании нередко используют эту систему отбора при приеме новых сотрудников на руководящие должности и формирование штата организации.
Первая группа крови появилась раньше других, обычно рождаются люди с сильным лидерским характером, общительные и энергичные. Человек с первой группой крови достаточно амбициозен, поэтому стремится сделать карьеру и добиться больших успехов в жизни. Это человек настроения, легко взрывается, очень эмоциональный. Коммуникабелен, легко знакомится с новыми людьми, имеет много друзей.
Вторая группа крови. Такие люди более стрессоустойчивы, терпеливы, любят гармонию и порядок, однако несколько упрямы. Бережливо относятся к деньгам, умеют их копить, хорошо готовят, умеют многое делать своими руками. Прекрасно ладят с людьми, и умело сглаживают острые углы в отношениях. Тяжелы на подъем.
Третья группа крови. Эти люди хорошо адаптируются к изменениям окружающей среды. Это властные, требовательны, но в тоже время впечатлительные и творческие личности, хорошо умеют анализировать ситуацию. Легко приспосабливаются к новым обстоятельствам и не бояться переезжать с места на место в поисках лучшей жизни. Независимы в принятии решений и не идут на поводу у чужого мнения.
Четвертая группа крови. Представители самой редкой группы крови исполнительные, чаще всего тонко чувствующие, с хрупкой и ранимой нервной системой, в жизни они привыкли руководствоваться чувствами. Хорошо развитая интуиция и даже наличие экстрасенсорных способностей. К недостаткам можно отнести постоянный внутренний конфликт.
Эти факты не являются научно доказанными, они формируются просто на основе наблюдений.
Группа крови и болезни
В отличие от диеты и характера, учёными была установлена связь между группой крови человека с некоторыми видами патологии.
Каждый тип крови — это своя система защиты против инфекций, вирусов, бактерий, токсичных соединений. Главные стражи нашего организма — антигены — прикреплены к красным кровяным клеткам наподобие усиков-антенн.
Обнаруживая вторжение на свою территорию, допустим, вируса, антигены вырабатывают антитела, которые устремляются к противнику и прилепляются к нему. В результате вирус теряет подвижность и становится очень липким. Далее происходит то, что ученые называют агглютинацией: вирусы слепляются группами, в результате чего выдворяются из организма.
Замечено, что вирусным гепатитом чаще болеют люди со второй группой крови (А), а менее устойчивы к вирусу гриппа лица с первой группой (0).
Если у вас первая группа, значит больше всего, вы подвержены заболеваниям желудочно-кишечного тракта, язвенной болезнью желудка и двенадцатиперстной кишки, аллергиям, бронхиальным астмам. Но имеете больше всего шансов дожить до старости в здравом уме, такие люди редко страдают старческим слабоумием, а также сердечно-сосудистыми заболеваниями, в том числе инсультами.
Лица со второй группой крови (А) чаще болеют раком желудка, поджелудочной железы, яичника, матки, ревматизмом, поясничным остеохондрозом, атеросклерозом, сахарным диабетом. У них часто отмечается нарушение свертываемости крови. В большей степени подвержены вирусным инфекциям.
Люди с третьей группой крови (В) больше других предрасположены к раку пищевода, полости рта. Такие люди в большей мере подвержены урогенитальным инфекциям и инфекциям, вызванным стрептококкам.
Люди с четвертой группой крови (АВ) чаще других страдают остеохондрозом позвоночника.
«Rh-» redirects here. For the Siddharta album, see Rh- (album). For the band, see The RH Factor. For the production company, see Regina Hall.
The Rh blood group system is a human blood group system. It contains proteins on the surface of red blood cells. After the ABO blood group system, it is the most likely to be involved in transfusion reactions. The Rh blood group system consists of 49 defined blood group antigens,[1] among which the five antigens D, C, c, E, and e are the most important. There is no d antigen. Rh(D) status of an individual is normally described with a positive (+) or negative (−) suffix after the ABO type (e.g., someone who is A+ has the A antigen and Rh(D) antigen, whereas someone who is A− has the A antigen but lacks the Rh(D) antigen). The terms Rh factor, Rh positive, and Rh negative refer to the Rh(D) antigen only. Antibodies to Rh antigens can be involved in hemolytic transfusion reactions and antibodies to the Rh(D) and Rh antigens confer significant risk of hemolytic disease of the fetus and newborn.
Nomenclature[edit]
| Fisher–Race | Wiener |
|---|---|
| Dce | R0 |
| DCe | R1 |
| DcE | R2 |
| DCE | RZ |
| dce | r |
| dCe | r’ |
| dcE | r″ |
| dCE | ry |
The Rh blood group system has two sets of nomenclatures: one developed by Ronald Fisher and R. R. Race, the other by Wiener. Both systems reflected alternative theories of inheritance. The Fisher–Race system, which is more commonly in use today, uses the CDE nomenclature. This system was based on the theory that a separate gene controls the product of each corresponding antigen (e.g., a «D gene» produces D antigen, and so on). However, the d gene was hypothetical, not actual.
The Wiener system used the Rh–Hr nomenclature. This system was based on the theory that there was one gene at a single locus on each of the 2 copies of chromosome 1, each contributing to production of multiple antigens. In this theory, a gene R1 is supposed to give rise to the «blood factors» Rh0, rh′, and rh″ (corresponding to modern nomenclature of the D, C, and E antigens) and the gene r to produce hr′ and hr″ (corresponding to modern nomenclature of the c and e antigens).[3]
Notations of the two theories are used interchangeably in blood banking (e.g., Rho(D) meaning RhD positive). Wiener’s notation is more complex and cumbersome for routine use. Because it is simpler to explain, the Fisher–Race theory has become more widely used.[citation needed]
DNA testing has shown that both are partially correct: There are in fact two linked genes, the RHD gene which produces a single immune specificity (anti-D) and the RHCE gene with multiple specificities (anti-C, anti-c, anti-E, anti-e). Thus, Wiener’s postulate that a gene could have multiple specificities (something many did not give credence to originally) has been proved to be correct. On the other hand, Wiener’s theory that there is only one gene has proved to be incorrect, as has the Fisher–Race theory that there are three genes, rather than the 2. The CDE notation used in the Fisher–Race nomenclature is sometimes rearranged to DCE to more accurately represent the co-location of the C and E encoding on the RhCE gene, and to make interpretation easier.[citation needed]
Antigens[edit]
The proteins which carry the Rh antigens are transmembrane proteins, whose structure suggest that they are ion channels.[4] The main antigens are D, C, E, c and e, which are encoded by two adjacent gene loci, the RHD gene which encodes the RhD protein with the D antigen (and variants)[5] and the RHCE gene which encodes the RhCE protein with the C, E, c and e antigens (and variants).[6] There is no d antigen. Lowercase «d» indicates the absence of the D antigen (the gene is usually deleted or otherwise nonfunctional).[citation needed]
1. This is the Rh-positive blood cell.
2. This is the Rh-negative blood cell.
3. These are the antigens on the Rh-positive blood cell that make it positive. The antigens allow the positive blood cell to attach to specific antibodies.
Rh phenotypes are readily identified through the presence or absence of the Rh surface antigens. As can be seen in the table below, most of the Rh phenotypes can be produced by several different Rh genotypes. The exact genotype of any individual can only be identified by DNA analysis. Regarding patient treatment, only the phenotype is usually of any clinical significance to ensure a patient is not exposed to an antigen they are likely to develop antibodies against. A probable genotype may be speculated on, based upon the statistical distributions of genotypes in the patient’s place of origin.[citation needed]
R0 (cDe or Dce) is today most common in Africa. The allele was thus often assumed in early blood group analyses to have been typical of populations on the continent; particularly in areas below the Sahara. Ottensooser et al. (1963) suggested that high R0 frequencies were likely characteristic of the ancient Judea Jews, who had emigrated from Egypt prior to their dispersal throughout the Mediterranean Basin and Europe[7] on the basis of high R0 percentages among Sephardi and Ashkenazi Jews compared to native European populations and the relative genetic isolation of Ashkenazim. However, more recent studies have found R0 frequencies as low as 24.3% among some Afroasiatic-speaking groups in the Horn of Africa,[8] as well as higher R0 frequencies among certain other Afroasiatic speakers in North Africa (37.3%)[9] and among some Palestinians in the Levant (30.4%).[10] On the contrary, at a frequency of 47.2% of the population of Basque country having the lack of the D antigen, these people display the highest frequency of the Rh negative phenotype.[11]
| Phenotype expressed on cell | Genotype expressed in DNA | Prevalence (%) |
|
|---|---|---|---|
| Fisher–Race notation | Wiener notation | ||
| D+ C+ E+ c+ e+ (RhD+) | Dce/DCE | R0RZ | 0.0125 |
| Dce/dCE | R0rY | 0.0003 | |
| DCe/DcE | R1R2 | 11.8648 | |
| DCe/dcE | R1r″ | 0.9992 | |
| DcE/dCe | R2r′ | 0.2775 | |
| DCE/dce | RZr | 0.1893 | |
| D+ C+ E+ c+ e− (RhD+) | DcE/DCE | R2RZ | 0.0687 |
| DcE/dCE | R2rY | 0.0014 | |
| DCE/dcE | RZr″ | 0.0058 | |
| D+ C+ E+ c− e+ (RhD+) | DCe/dCE | R1rY | 0.0042 |
| DCE/dCe | RZr′ | 0.0048 | |
| DCe/DCE | R1RZ | 0.2048 | |
| D+ C+ E+ c− e− (RhD+) | DCE/DCE | RZRZ | 0.0006 |
| DCE/dCE | RZrY | < 0.0001 | |
| D+ C+ E− c+ e+ (RhD+) | Dce/dCe | R0r′ | 0.0505 |
| DCe/dce | R1r | 32.6808 | |
| DCe/Dce | R1R0 | 2.1586 | |
| D+ C+ E− c− e+ (RhD+) | DCe/DCe | R1R1 | 17.6803 |
| DCe/dCe | R1r′ | 0.8270 | |
| D+ C− E+ c+ e+ (RhD+) | DcE/Dce | R2R0 | 0.7243 |
| Dce/dcE | R0r″ | 0.0610 | |
| DcE/dce | R2r | 10.9657 | |
| D+ C− E+ c+ e− (RhD+) | DcE/DcE | R2R2 | 1.9906 |
| DcE/dcE | R2r″ | 0.3353 | |
| D+ C− E− c+ e+ (RhD+) | Dce/Dce | R0R0 | 0.0659 |
| Dce/dce | R0r | 1.9950 | |
| D− C+ E+ c+ e+ (RhD−) | dce/dCE | rrY | 0.0039 |
| dCe/dcE | r′r″ | 0.0234 | |
| D− C+ E+ c+ e− (RhD−) | dcE/dCE | r″rY | 0.0001 |
| D− C+ E+ c− e+ (RhD−) | dCe/dCE | r′rY | 0.0001 |
| D− C+ E+ c− e− (RhD−) | dCE/dCE | rYrY | < 0.0001 |
| D− C+ E− c+ e+ (RhD−) | dce/dCe | rr′ | 0.7644 |
| D− C+ E− c− e+ (RhD−) | dCe/dCe | r′r′ | 0.0097 |
| D− C− E+ c+ e+ (RhD−) | dce/dcE | rr″ | 0.9235 |
| D− C− E+ c+ e− (RhD−) | dcE/dcE | r″r″ | 0.0141 |
| D− C− E− c+ e+ (RhD−) | dce/dce | rr | 15.1020 |
• Figures taken from a study performed in 1948 on a sample of 2000 people in the United Kingdom.[12]
| Rh Phenotype | CDE | Patients (%) | Donors (%) |
|---|---|---|---|
| R1r | CcDe | 37.4 | 33.0 |
| R1R2 | CcDEe | 35.7 | 30.5 |
| R1R1 | CDe | 5.7 | 21.8 |
| rr | ce | 10.3 | 11.6 |
| R2r | cDEe | 6.6 | 10.4 |
| R0R0 | cDe | 2.8 | 2.7 |
| R2R2 | cDE | 2.8 | 2.4 |
| rr″ | cEe | – | 0.98 |
| RZRZ | CDE | – | 0.03 |
| rr′ | Cce | 0.8 | – |
Rh antibodies[edit]
Rh antibodies are Immunoglobulin G (IgG) antibodies which are acquired through exposure to Rh-positive blood (generally either through pregnancy or transfusion of blood products). The D antigen is the most immunogenic of all the non-ABO antigens. Approximately 80% of individuals who are D-negative and exposed to a single D-positive unit will produce an anti-D antibody. The percentage of alloimmunization is significantly reduced in patients who are actively exsanguinating.[14]
All Rh antibodies except D display dosage (antibody reacts more strongly with red cells homozygous for an antigen than cells heterozygous for the antigen (EE stronger reaction vs Ee).
If anti-E is detected, the presence of anti-c should be strongly suspected (due to combined genetic inheritance). It is therefore common to select c-negative and E-negative blood for transfusion patients who have an anti-E and lack the c antigen (in general, a patient will not produce antibodies against their own antigens). Anti-c is a common cause of delayed hemolytic transfusion reactions.[15]
Hemolytic disease of the newborn[edit]
The hemolytic condition occurs when there is an incompatibility between the blood types of the mother and fetus. There is also potential incompatibility if the mother is Rh negative and the father is positive. When any incompatibility is detected, the mother often receives an injection at 28 weeks gestation and at birth to avoid the development of antibodies towards the fetus. These terms do not indicate which specific antigen-antibody incompatibility is implicated. The disorder in the fetus due to Rh D incompatibility is known as erythroblastosis fetalis.
- Hemolytic comes from two words: «hema» (blood) and «lysis» (solution) or breaking down of red blood cells
- Erythroblastosis refers to the making of immature red blood cells
- Fetalis refers to the fetus.
When the condition is caused by the Rh D antigen-antibody incompatibility, it is called Rh D Hemolytic disease of the newborn or Rh disease. Here, sensitization to Rh D antigens (usually by feto-maternal transfusion during pregnancy) may lead to the production of maternal IgG anti-D antibodies which can pass through the placenta. This is of particular importance to D negative females at or below childbearing age, because any subsequent pregnancy may be affected by the Rh D hemolytic disease of the newborn if the baby is D positive. The vast majority of Rh disease is preventable in modern antenatal care by injections of IgG anti-D antibodies (Rho(D) Immune Globulin). The incidence of Rh disease is mathematically related to the frequency of D negative individuals in a population, so Rh disease is rare in old-stock populations of Africa and the eastern half of Asia, and the Indigenous peoples of Oceania and the Americas, but more common in other genetic groups, most especially Western Europeans, but also other West Eurasians, and to a lesser degree, native Siberians, as well as those of mixed-race with a significant or dominant descent from those (e.g. the vast majority of Latin Americans and Central Asians).
- Symptoms and signs in the fetus:
- Enlarged liver, spleen, or heart and fluid buildup in the fetus’ abdomen seen via ultrasound.
- Symptoms and signs in the newborn:
- Anemia that creates the newborn’s pallor (pale appearance).
- Jaundice or yellow discoloration of the newborn’s skin, sclera or mucous membrane. This may be evident right after birth or after 24–48 hours after birth. This is caused by bilirubin (one of the end products of red blood cell destruction).
- Enlargement of the newborn’s liver and spleen.
- The newborn may have severe edema of the entire body.
- Dyspnea (difficulty breathing)
Other animals with Rh-like antigens causing hemolytic disease of the newborn
Rh disease only occurs in human fetuses however a similar disease called Neonatal isoerythrolysis (NI) can be observed in animal species of newborn horses, mules, pigs, cats, cattle, and dogs. What differs between Rh disease and NI is the pathogenesis of hemolysis between human fetuses and the animal species. With human mothers, the maternal antibodies are formed from the sensitization of foreign antigens of her unborn fetus’s red blood cells passing through the placenta causing hemolysis before birth, with other animals however, these maternal antibodies are not passed through the placenta but through colostrum. The newborn animal is without NI but soon develops hemolytic anemia after initial ingestion of its mother’s colostrum that contain antibodies that can be absorbed through the newborn’s intestines and are incompatible to its red blood cell antigen. After 48 hours of birth, the newborn may be allowed to nurse from its mother as her antibodies can no longer be absorbed through the neonate’s intestines. Because the most active newborn animals consume the most colostrum, they may be the ones who are most affected by the blood incompatibility of antigen and antibody.[16]
Rh proteins outside of human species
Rh molecules can be found in many different living organisms from worms, bacteria, algae, and other vertebrates. These Rh molecules from different animals have the same biochemical function-differing slightly in their amino acid sequences.[17] The Rh proteins in other species, however, do not correspond with the Rh blood group or antigens found on human red blood cells. One such example would be the nematode Caenorhabditis elegans. Because this worm does not have red blood cells, it cannot have Rh antigens, excluding it from having a Rh blood type. These Rh proteins therefore do not bind to red blood cells; they operate independently. Instead of transporting CO2 from the proteins of human red blood cells, C. elegan’s Rh proteins transport NH3 out of its body.[18]
Population data[edit]
According to a comprehensive study, the worldwide frequency of Rh-positive and Rh-negative blood types is approximately 94% and 6%, respectively. The same study concluded that the share of the population with Rh-negative blood type is set to fall further in the future primarily due to low population growth in Europe.[19] The frequency of Rh factor blood types and the RhD neg allele gene differs in various populations.[citation needed]
| Population | Rh(D) Neg | Rh(D) Pos | Rh(D) Neg alleles |
|---|---|---|---|
| African Americans | ∼ 7% | 93% | ∼ 26% |
| Albania[21] | 10.86% | 89% | weak D 1.4% |
| Basques[22] | 21%–36% | 65% | ∼ 60% |
| Britain[23] | 17% | 83% | |
| China[23] | < 1% | > 99% | |
| Ethiopians[23] | 1%–21% | 99%–79% | |
| Europeans (others) | 16% | 84% | 40% |
| India[23] | 0.6%–8.4% | 99.4%–91.6% | |
| Indonesia[23] | < 1% | > 99% | |
| Japan[23] | < 1% | > 99% | |
| Koreans[24] | < 1% | > 99% | |
| Madagascar[23] | 1% | 99% | |
| Moroccans[25] | 9.5% | 90.5% | |
| Moroccans (High Atlas)[26] | ∼ 29% | 71% | |
| Native Americans | ∼ 1% | 99% | ∼ 10% |
| Nigeria[27] | 6% | 94% | |
| Saudi Arabia[28] | 8.8% | 91.2% | 29.5% |
| Subequatorial Africa[23] | 1%–3% | 99%–97% | |
| United States[23] | 15% | 85% |
Genetics[edit]
This is a Punnett square for Rh factor inheritance. This square specifically shows two heterozygous Rh positive parents and the possible genotypes/phenotypes the offspring could have.
The D antigen is inherited as one gene (RHD) (on the short arm of the first chromosome, p36.13–p34.3) with various alleles. Typically, Rhesus positive people have an intact RHD gene while negative people lack the gene (or have mutations in it). However, there are exceptions: for instance, Japanese and black Africans may have an intact gene that is not expressed or only at very low levels.[29] The gene codes for the RhD protein on the red blood cell membrane. D− individuals who lack a functional RHD gene do not produce the D antigen, and may be immunized by D+ blood.[citation needed]
The D antigen is a dominant trait. If both of a child’s parents are Rh negative, the child will definitely be Rh negative. Otherwise the child may be Rh positive or Rh negative, depending on the parents’ specific genotypes.[30]
The epitopes for the next 4 most common Rh antigens, C, c, E and e are expressed on the highly similar RhCE protein that is genetically encoded in the RHCE gene, also found on chromosome 1. It has been shown that the RHD gene arose by duplication of the RHCE gene during primate evolution. Mice have just one RH gene.[31]
The RHAG gene, which is responsible for encoding Rh-associated glycoprotein (RhAG), is found on chromosome 6a.
The polypeptides produced from the RHD and RHCE genes form a complex on the red blood cell membrane with the Rh-associated glycoprotein.[15]
Function[edit]
| Blood group Rh C/E/D polypeptide | |
|---|---|
| Identifiers | |
| Symbol | ? |
| InterPro | IPR002229 |
On the basis of structural homology it has been proposed that the product of RHD gene, the RhD protein, is a membrane transport protein of uncertain specificity (CO2 or NH3) and unknown physiological role.[32][33] The three-dimensional structure of the related RHCG protein and biochemical analysis of the RhD protein complex indicates that the RhD protein is one of three subunits of an ammonia transporter.[34][35] Three recent studies[36][37][38] have reported a protective effect of the RhD-positive phenotype, especially RhD heterozygosity, against the negative effect of latent toxoplasmosis on psychomotor performance in infected subjects. RhD-negative compared to RhD-positive subjects without anamnestic titres of anti-Toxoplasma antibodies have shorter reaction times in tests of simple reaction times. And conversely, RhD-negative subjects with anamnestic titres (i.e. with latent toxoplasmosis) exhibited much longer reaction times than their RhD-positive counterparts. The published data suggested that only the protection of RhD-positive heterozygotes was long term in nature; the protection of RhD-positive homozygotes decreased with duration of the infection while the performance of RhD-negative homozygotes decreased immediately after the infection. The overall change in reaction times was always larger in the RhD-negative group than in the RhD-positive.[citation needed]
RHD polymorphism[edit]
Origin of RHD polymorphism[edit]
For a long time, the origin of RHD polymorphism was an evolutionary enigma.[39][40][41] Before the advent of modern medicine, the carriers of the rarer allele (e.g. RhD-negative women in a population of RhD positives or RhD-positive men in a population of RhD negatives) were at a disadvantage as some of their children (RhD-positive children born to preimmunised RhD-negative mothers) were at a higher risk of fetal or newborn death or health impairment from hemolytic disease.[citation needed]
Natural selection aside, the RHD-RHCE region is structurally predisposed to many mutations seen in humans, since the pair arose by gene duplication and remain similar enough for unequal crossing over to occur.[31] In addition to the case where D is deleted, crossover can also produce a single gene mixing exons from both RHD and RHCE, forming the majority of partial D types.[42]: 323
Weak D[edit]
| Weak D | Partial D | |
|---|---|---|
| Change in D | Decreased amount | Structural alternation |
| Can donate as if being: |
D positive | D positive |
| Can receive blood as if being: |
D positive (usually)[42] | D negative[15] |
In serologic testing, D positive blood is easily identified. Units that are D negative are often retested to rule out a weaker reaction. This was previously referred to as Du, which has been replaced.[42]: 322 By definition, weak D phenotype is characterized by negative reaction with anti-D reagent at immediate spin (IS), negative reaction after 37 °C incubation, and positive reaction at anti-human globulin (AHG) phase. Weak D phenotype can occur in several ways. In some cases, this phenotype occurs because of an altered surface protein that is more common in people of European descent. An inheritable form also occurs, as a result of a weakened form of the R0 gene. Weak D may also occur as «C in trans», whereby a C gene is present on the opposite chromosome to a D gene (as in the combination R0r’, or «Dce/dCe»). The testing is difficult, since using different anti-D reagents, especially the older polyclonal reagents, may give different results.
The practical implication of this is that people with this sub-phenotype will have a product labeled as «D positive» when donating blood. When receiving blood, they are sometimes typed as a «D negative», though this is the subject of some debate. Most «Weak D» patients can receive «D positive» blood without complications.[42]: 323 However, it is important to correctly identify the ones that have to be considered D+ or D−. This is important, since most blood banks have a limited supply of «D negative» blood and the correct transfusion is clinically relevant. In this respect, genotyping of blood groups has much simplified this detection of the various variants in the Rh blood group system.
Partial D[edit]
It is important to differentiate weak D (due to a quantitative difference in the D antigen) from partial D (due to a qualitative difference in the D antigen). Simply put, the weak D phenotype is due to a reduced number of D antigens on a red blood cell. In contrast, the partial D phenotype is due to an alteration in D-epitopes. Thus, in partial D, the number of D antigens is not reduced but the protein structure is altered. These individuals, if alloimmunized to D, can produce an anti-D antibody. Therefore, partial D patients who are donating blood should be labeled as D-positive but, if receiving blood, they should be labeled as D-negative and receive D-negative units.[15]
In the past, partial D was called ‘D mosaic’ or ‘D variant.’ Different partial D phenotypes are defined by different D epitopes on the outer surface of the red blood cell membrane. More than 30 different partial D phenotypes have been described.[15]
Rhnull phenotype[edit]
Rhnull individuals have no Rh antigens (no Rh or RhAG) on their red blood cells.[43] This rare condition[43] has been called «Golden Blood».[44] As a consequence of Rh antigen absence, Rhnull red blood cells also lack LW and Fy5 and show weak expression of S, s, and U antigens.
Red blood cells lacking Rh/RhAG proteins have structural abnormalities (such as stomatocytosis) and cell membrane defects that can result in hemolytic anemia.[15][43]
The first Rhnull blood was discovered in an Aboriginal Australian woman, in 1961.[45] Only 43 individuals have been reported to have it worldwide. Only nine active donors have been reported.[44] Its properties make it attractive in numerous medical applications, but scarcity makes it expensive to transport and acquire.[46]
Other Rh group antigens[edit]
Currently, 50 antigens have been described in the Rh group system; among those described here, the D, C, c, E and e antigens are the most important. The others are much less frequently encountered or are rarely clinically significant. Each is given a number, though the highest assigned number (CEVF or RH61 according to the ISBT terminology) is not an accurate reflection of the antigens encountered since many (e.g. Rh38) have been combined, reassigned to other groups, or otherwise removed.[42]: 324
Some of the other Rh «antigens» are f («ce», RH6), Ce (RH7), Cw (RH8), Cx (RH9), V (RH10), Ew (RH11), G (RH12), Tar (RH40), VS (RH20), Dw (RH23), and CE (RH22). Some of these groups, including f, Ce and CE, describe grouping of some existing groups. Others, like V, describe an epitope created by some other mutation on the RHD and RHCE genes. V in particular is caused by a mutation on RHCE.[47]
History[edit]
The term «Rh» was originally an abbreviation of «Rhesus factor». It was discovered in 1937 by Karl Landsteiner and Alexander S. Wiener, who, at the time, believed it to be a similar antigen found in rhesus macaque red blood cells. It was subsequently discovered that the human factor is not identical to the rhesus monkey factor, but by then, «Rhesus Group» and like terms were already in widespread, worldwide use. Thus, notwithstanding it is a misnomer, the term survives (e.g., rhesus blood group system and the obsolete terms rhesus factor, rhesus positive, and rhesus negative – all three of which actually refer specifically and only to the Rh D factor and are thus misleading when unmodified). Contemporary practice is to use «Rh» as a term of art instead of «Rhesus» (e.g., «Rh Group», «Rh factors», «Rh D», etc.).
The significance of their discovery was not immediately apparent and was only realized in 1940, after subsequent findings by Philip Levine and Rufus Stetson.[48] The serum that led to the discovery was produced by immunizing rabbits with red blood cells from a rhesus macaque. The antigen that induced this immunization was designated by them as Rh factor to indicate that rhesus blood had been used for the production of the serum.[49]
In 1939, Phillip Levine and Rufus Stetson published in a first case report the clinical consequences of non-recognized Rh factor, hemolytic transfusion reaction, and hemolytic disease of the newborn in its most severe form.[50] It was recognized that the serum of the reported woman agglutinated with red blood cells of about 80% of the people although the then known blood groups, in particular ABO were matched. No name was given to this agglutinin when described. In 1940, Karl Landsteiner and Alexander S. Wiener made the connection to their earlier discovery, reporting a serum that also reacted with about 85% of different human red blood cells.[51]
In 1941, Group O: a patient of Dr. Paul in Irvington, NJ, delivered a normal infant in 1931; this pregnancy was followed by a long period of sterility. The second pregnancy (April, 1941) resulted in an infant with icterus gravis.[52] In May 1941, the third anti-Rh serum (M.S.) of Group O became available.[52]
Based on the serologic similarities, Rh factor was later also used for antigens, and anti-Rh for antibodies, found in humans such as those previously described by Levine and Stetson. Although differences between these two sera were shown already in 1942 and clearly demonstrated in 1963, the already widely used term «Rh» was kept for the clinically described human antibodies which are different from the ones related to the rhesus monkey. This real factor found in rhesus macaque was classified in the Landsteiner-Weiner antigen system (antigen LW, antibody anti-LW) in honor of the discoverers.[53][54]
It was recognized that the Rh factor was just one in a system of various antigens. Based on different models of genetic inheritance, two different terminologies were developed; both of them are still in use.
The clinical significance of this highly immunizing D antigen (i.e., Rh factor) was soon realized. Some keystones were to recognize its importance for blood transfusion (including reliable diagnostic tests), hemolytic disease of the newborn (including exchange transfusion), and very importantly the prevention of it by screening and prophylaxis.
The discovery of fetal cell-free DNA in maternal circulation by Holzgrieve et al. led to the noninvasive genotyping of fetal Rh genes in many countries.
References[edit]
- ^ Dean, Laura. Blood Groups and Red Cell Antigens [Internet].. Bethesda (MD): National Center for Biotechnology Information (US); 2005, Chapter. 7.
- ^ «Rh System». Canadian Blood Services at learnserology.ca. Retrieved 2021-01-19.
- ^ Weiner AS (1 February 1949). «Genetics and Nomenclature of the Rh–Hr Blood Types». Antonie van Leeuwenhoek. 15 (1): 17–28. doi:10.1007/BF02062626. ISSN 0003-6072. S2CID 35680084.
- ^ «dbRBC – Blood Group Antigen Gene Mutation Database». www.ncbi.nlm.nih.gov. Archived from the original on 2011-02-13. Retrieved 2010-06-15.
- ^ «RHD Rh blood group, D antigen [Homo sapiens] – Gene Result». nlm.nih.gov. Retrieved 2010-06-15.
- ^ «RHCE Rh blood group, CcEe antigens [Homo sapiens] – Gene Result». nlm.nih.gov. Archived from the original on 2010-03-20. Retrieved 2010-06-15.
- ^ Ottensooser F, Leon N, Sato M, Saldanha PH (March 1963). «Blood groups of a population of Ashkenazi Jews in Brazil». American Journal of Physical Anthropology. 21 (1): 41–8. doi:10.1002/ajpa.1330210106. PMID 13940710. S2CID 21795826.
- ^ Harrison GA, Küchemann CF, Moore MA, Boyce AJ, Baju T, Mourant AE, et al. (1969). «The effects of altitudinal variation in Ethiopian populations». Philosophical Transactions of the Royal Society of London B: Biological Sciences. 256 (805): 147–182. Bibcode:1969RSPTB.256..147H. doi:10.1098/rstb.1969.0040.
- ^ Metri AA, Sidi-Yakhlef A, Biémont C, Saidi M, Chaif O, Ouraghi SA (2012). «A genetic study of nine populations from the region of Tlemcen in Western Algeria: a comparative analysis on the Mediterranean scale». Anthropological Science. 120 (3): 209–216. doi:10.1537/ase.120618. Archived from the original on 29 August 2017. Retrieved 28 August 2017.
- ^ El-Wahhab Skaik YA (July 2011). «The Rh allele frequencies in Gaza city in Palestine». Asian Journal of Transfusion Science. 5 (2): 150–2. doi:10.4103/0973-6247.83241. PMC 3159245. PMID 21897594.
- ^ Flores-Bello A, Mas-Ponte D, Rosu ME, Bosch E, Calafell F, Comas D (December 2018). «Sequence diversity of the Rh blood group system in Basques». European Journal of Human Genetics. 26 (12): 1859–1866. doi:10.1038/s41431-018-0232-1. PMC 6244411. PMID 30089826.
- ^ Race RR, Mourant AE (June 1948). «The Rh chromosome frequencies in England». Blood. 3 (6): 689–95. doi:10.1182/blood.V3.6.689.689. PMID 18860341.
- ^ Canatan D, Acar N, Kiliç B (1999). «Rh Subgroups and Kell Antigens in Patients With Thalassemia and in Donors in Turkey» (PDF). Turkish Journal of Medical Sciences. 29: 155–7. Archived from the original (PDF) on 2008-12-17. Retrieved 2008-10-17.
- ^ Roback et al. AABB Technical Manual, 16th Ed. Bethesda, AABB Press, 2008.
- ^ a b c d e f Mais, DD. ASCP Quick Compendium of Clinical Pathology, 2nd Ed. Chicago, ASCP Press, 2009.
- ^ Cotter S (June 1, 2001). Hematology. Quick Look Series (1st ed.). Teton NewMedia. pp. 32–33. ISBN 978-1893441361.
- ^ Ji Q, Hashmi S, Liu Z, Zhang J, Chen Y, Huang CH (April 2006). «CeRh1 (rhr-1) is a dominant Rhesus gene essential for embryonic development and hypodermal function in Caenorhabditis elegans». Proceedings of the National Academy of Sciences of the United States of America. 103 (15): 5881–5886. doi:10.1073/pnas.0600901103. PMC 1458667. PMID 16595629.
- ^ «What is Rhesus factor? Did we get it from Rhesus monkeys? Can Rh factor be found in other animals?». The Tech Interactive. 2018-11-20. Retrieved 2022-10-24.
- ^ «Blood Type Frequencies by Country including the Rh Factor – Rhesus Negative».
- ^ Mack S (March 21, 2001). «Re: Is the RH negative blood type more prevalent in certain ethnic groups?». MadSci Network. Archived from the original on February 24, 2011.
- ^ Xhetani M, Seferi I, Férec C, Zoraqi G, Fichou Y (October 2014). «Distribution of Rhesus blood group antigens and weak D alleles in the population of Albania». Blood Transfusion = Trasfusione del Sangue. 12 (4): 565–9. doi:10.2450/2014.0240-13. PMC 4212038. PMID 24960662.
- ^ Touinssi M, Chiaroni J, Degioanni A, De Micco P, Dutour O, Bauduer F (2004). «Distribution of rhesus blood group system in the French basques: a reappraisal using the allele-specific primers PCR method». Human Heredity. 58 (2): 69–72. doi:10.1159/000083027. PMID 15711086. S2CID 44542508.
- ^ a b c d e f g h i Golassa L, Tsegaye A, Erko B, Mamo H (July 2017). «High rhesus (Rh(D)) negative frequency and ethnic-group based ABO blood group distribution in Ethiopia». BMC Research Notes. 10 (1): 330. doi:10.1186/s13104-017-2644-3. PMC 5530478. PMID 28747227.
- ^ Kim JY, Kim SY, Kim CA, Yon GS, Park SS (March 2005). «Molecular characterization of D- Korean persons: development of a diagnostic strategy». Transfusion. 45 (3): 345–52. doi:10.1111/j.1537-2995.2005.04311.x. PMID 15752151. S2CID 42899178.
- ^ Wafi ME, Housse HE, Nourichafi N, Bouisk K, Benajiba M, Habti N (2016). «Prevalence of weak D phenotype among D negative C/E+ blood donors in Morocco» (PDF). International Journal of Blood Transfusion and Immunohematology. 6 (1): 3–7. doi:10.5348/ijbti-2016-22-OA-2. Archived (PDF) from the original on August 28, 2016. Retrieved February 3, 2018.
- ^ Weinstock C (January 2014). «It is worthwhile filling in the remaining blank spots for blood group antigen frequencies». Blood Transfusion = Trasfusione del Sangue. 12 (1): 3–6. doi:10.2450/2013.0192-13. PMC 3926725. PMID 24120599.
- ^ Enosolease ME, Bazuaye GN (January 2008). «Distribution of ABO and Rh-D blood groups in the Benin area of Niger-Delta: Implication for regional blood transfusion». Asian Journal of Transfusion Science. 2 (1): 3–5. doi:10.4103/0973-6247.39502. PMC 2798756. PMID 20041069.
- ^ Eweidah MH, Rahiman S, Ali MH, Al-Shamary AM (April 2011). «Distribution of ABO and Rhesus (RHD) Blood Groups in Al-Jouf Province of the Saudi Arabia» (PDF). The Anthropologist. 13 (2): 99–102. doi:10.1080/09720073.2011.11891182. S2CID 75537061. Archived (PDF) from the original on January 2, 2013. Retrieved February 3, 2018.
- ^ Avent ND, Reid ME (January 2000). «The Rh blood group system: a review». Blood. 95 (2): 375–387. doi:10.1182/blood.V95.2.375. PMID 10627438. S2CID 13803474.
- ^ «ABO inheritance patterns». Inheritance patterns of blood groups. Australian Red Cross Blood Service. Archived from the original on 1 November 2013. Retrieved 30 October 2013.
- ^ a b Wagner FF, Flegel WA (March 2002). «RHCE represents the ancestral RH position, while RHD is the duplicated gene». Blood. 99 (6): 2272–3. doi:10.1182/blood-2001-12-0153. PMID 11902138.
- ^ Kustu S, Inwood W (2006). «Biological gas channels for NH3 and CO2: evidence that Rh (Rhesus) proteins are CO2 channels». Transfusion Clinique et Biologique. 13 (1–2): 103–10. doi:10.1016/j.tracli.2006.03.001. PMID 16563833.
- ^ Biver S, Scohy S, Szpirer J, Szpirer C, André B, Marini AM (2006). «Physiological role of the putative ammonium transporter RhCG in the mouse». Transfusion Clinique et Biologique. 13 (1–2): 167–8. doi:10.1016/j.tracli.2006.03.003. PMID 16564721.
- ^ Gruswitz F, Chaudhary S, Ho JD, Schlessinger A, Pezeshki B, Ho CM, et al. (May 2010). «Function of human Rh based on structure of RhCG at 2.1 A». Proceedings of the National Academy of Sciences of the United States of America. 107 (21): 9638–43. Bibcode:2010PNAS..107.9638G. doi:10.1073/pnas.1003587107. PMC 2906887. PMID 20457942.
- ^ Westhoff CM (January 2007). «The structure and function of the Rh antigen complex». Seminars in Hematology. 44 (1): 42–50. doi:10.1053/j.seminhematol.2006.09.010. PMC 1831834. PMID 17198846.
- ^ Novotná M, Havlícek J, Smith AP, Kolbeková P, Skallová A, Klose J, et al. (September 2008). «Toxoplasma and reaction time: role of toxoplasmosis in the origin, preservation and geographical distribution of Rh blood group polymorphism». Parasitology. 135 (11): 1253–61. doi:10.1017/S003118200800485X. PMID 18752708. S2CID 5956901.
- ^ Flegr J, Novotná M, Lindová J, Havlícek J (August 2008). «Neurophysiological effect of the Rh factor. Protective role of the RhD molecule against Toxoplasma-induced impairment of reaction times in women» (PDF). Neuro Endocrinology Letters. 29 (4): 475–81. PMID 18766148.
- ^ Flegr J, Klose J, Novotná M, Berenreitterová M, Havlícek J (May 2009). «Increased incidence of traffic accidents in Toxoplasma-infected military drivers and protective effect RhD molecule revealed by a large-scale prospective cohort study». BMC Infectious Diseases. 9: 72. doi:10.1186/1471-2334-9-72. PMC 2692860. PMID 19470165.
- ^ Haldane JB (1942). «Selection against heterozygosis in Man». Annals of Eugenics. 11: 333–340. doi:10.1111/j.1469-1809.1941.tb02297.x.
- ^ Fisher RA, Race RR, Taylor GL (1944). «Mutation and the Rhesus reaction». Nature. 153 (3873): 106. Bibcode:1944Natur.153..106F. doi:10.1038/153106b0. S2CID 2104065.
- ^ Li CC (1953). «Is the Rh facing a crossroad? A critique of the compensation effect». Am Nat. 87 (835): 257–261. doi:10.1086/281782. S2CID 84715943.
- ^ a b c d e Brecher ME (2005). Technical Manual (15th ed.). Bethesda MD: American Association of Blood Banks. ISBN 978-1-56395-196-1.
- ^ a b c Cartron JP (December 1999). «RH blood group system and molecular basis of Rh-deficiency». Bailliere’s Best Practice & Research. Clinical Haematology. 12 (4): 655–89. doi:10.1053/beha.1999.0047. PMID 10895258.
- ^ a b «Rhnull, the Rarest Blood Type on Earth, Has Been Called the «Golden Blood»«. Curiosity.com. Archived from the original on 5 December 2019. Retrieved 2019-06-05.
- ^ «J-STAGE».
- ^ Bailey P. «The man with the golden blood». Mosaic Science. Retrieved 16 January 2019.
- ^ «Rh System: Anti-V». Professional Education. 2 October 2019. Archived from the original on 7 November 2020.
- ^ Landsteiner K, Wiener AS (1940). «An Agglutinable Factor in Human Blood Recognized by Immune Sera for Rhesus Blood». Exp Biol Med (Maywood). 43 (1): 223. doi:10.3181/00379727-43-11151. S2CID 58298368.
- ^ Landsteiner K, Wiener AS (September 1941). «Studies on an agglutinogen (Rh) in human blood reacting with anti-rhesus sera and with human isoantibodies». The Journal of Experimental Medicine. 74 (4): 309–20. doi:10.1084/jem.74.4.309. PMC 2135190. PMID 19871137.
- ^ Levine P, Stetson RE (1939). «An unusual case of intragroup agglutination». JAMA. 113 (2): 126–7. doi:10.1001/jama.1939.72800270002007a.
- ^ Landsteiner K, Wiener AS (1940). «An agglutinable factor in human blood recognized by immune sera for rhesus blood». Proc Soc Exp Biol Med. 43: 223–4. doi:10.3181/00379727-43-11151. S2CID 58298368.
- ^ a b Levine P, Burnham L, Katzin E, Vogel P (December 1941). «The role of iso-immunization in the pathogenesis of erythroblastosis fetalis». American Journal of Obstetrics and Gynecology. 42 (6): 925–937. doi:10.1016/S0002-9378(41)90260-0. ISSN 0002-9378.
- ^ Avent ND, Reid ME (January 2000). «The Rh blood group system: a review». Blood. 95 (2): 375–87. doi:10.1182/blood.V95.2.375. PMID 10627438. S2CID 13803474.
- ^ Scott ML (July 2004). «The complexities of the Rh system». Vox Sanguinis. 87 (Suppl. 1): 58–62. doi:10.1111/j.1741-6892.2004.00431.x. PMID 15200606. S2CID 42103877.
External links[edit]
- Rh at BGMUT Blood Group Antigen Gene Mutation Database at NCBI, NIH
«Rh-» redirects here. For the Siddharta album, see Rh- (album). For the band, see The RH Factor. For the production company, see Regina Hall.
The Rh blood group system is a human blood group system. It contains proteins on the surface of red blood cells. After the ABO blood group system, it is the most likely to be involved in transfusion reactions. The Rh blood group system consists of 49 defined blood group antigens,[1] among which the five antigens D, C, c, E, and e are the most important. There is no d antigen. Rh(D) status of an individual is normally described with a positive (+) or negative (−) suffix after the ABO type (e.g., someone who is A+ has the A antigen and Rh(D) antigen, whereas someone who is A− has the A antigen but lacks the Rh(D) antigen). The terms Rh factor, Rh positive, and Rh negative refer to the Rh(D) antigen only. Antibodies to Rh antigens can be involved in hemolytic transfusion reactions and antibodies to the Rh(D) and Rh antigens confer significant risk of hemolytic disease of the fetus and newborn.
Nomenclature[edit]
| Fisher–Race | Wiener |
|---|---|
| Dce | R0 |
| DCe | R1 |
| DcE | R2 |
| DCE | RZ |
| dce | r |
| dCe | r’ |
| dcE | r″ |
| dCE | ry |
The Rh blood group system has two sets of nomenclatures: one developed by Ronald Fisher and R. R. Race, the other by Wiener. Both systems reflected alternative theories of inheritance. The Fisher–Race system, which is more commonly in use today, uses the CDE nomenclature. This system was based on the theory that a separate gene controls the product of each corresponding antigen (e.g., a «D gene» produces D antigen, and so on). However, the d gene was hypothetical, not actual.
The Wiener system used the Rh–Hr nomenclature. This system was based on the theory that there was one gene at a single locus on each of the 2 copies of chromosome 1, each contributing to production of multiple antigens. In this theory, a gene R1 is supposed to give rise to the «blood factors» Rh0, rh′, and rh″ (corresponding to modern nomenclature of the D, C, and E antigens) and the gene r to produce hr′ and hr″ (corresponding to modern nomenclature of the c and e antigens).[3]
Notations of the two theories are used interchangeably in blood banking (e.g., Rho(D) meaning RhD positive). Wiener’s notation is more complex and cumbersome for routine use. Because it is simpler to explain, the Fisher–Race theory has become more widely used.[citation needed]
DNA testing has shown that both are partially correct: There are in fact two linked genes, the RHD gene which produces a single immune specificity (anti-D) and the RHCE gene with multiple specificities (anti-C, anti-c, anti-E, anti-e). Thus, Wiener’s postulate that a gene could have multiple specificities (something many did not give credence to originally) has been proved to be correct. On the other hand, Wiener’s theory that there is only one gene has proved to be incorrect, as has the Fisher–Race theory that there are three genes, rather than the 2. The CDE notation used in the Fisher–Race nomenclature is sometimes rearranged to DCE to more accurately represent the co-location of the C and E encoding on the RhCE gene, and to make interpretation easier.[citation needed]
Antigens[edit]
The proteins which carry the Rh antigens are transmembrane proteins, whose structure suggest that they are ion channels.[4] The main antigens are D, C, E, c and e, which are encoded by two adjacent gene loci, the RHD gene which encodes the RhD protein with the D antigen (and variants)[5] and the RHCE gene which encodes the RhCE protein with the C, E, c and e antigens (and variants).[6] There is no d antigen. Lowercase «d» indicates the absence of the D antigen (the gene is usually deleted or otherwise nonfunctional).[citation needed]
1. This is the Rh-positive blood cell.
2. This is the Rh-negative blood cell.
3. These are the antigens on the Rh-positive blood cell that make it positive. The antigens allow the positive blood cell to attach to specific antibodies.
Rh phenotypes are readily identified through the presence or absence of the Rh surface antigens. As can be seen in the table below, most of the Rh phenotypes can be produced by several different Rh genotypes. The exact genotype of any individual can only be identified by DNA analysis. Regarding patient treatment, only the phenotype is usually of any clinical significance to ensure a patient is not exposed to an antigen they are likely to develop antibodies against. A probable genotype may be speculated on, based upon the statistical distributions of genotypes in the patient’s place of origin.[citation needed]
R0 (cDe or Dce) is today most common in Africa. The allele was thus often assumed in early blood group analyses to have been typical of populations on the continent; particularly in areas below the Sahara. Ottensooser et al. (1963) suggested that high R0 frequencies were likely characteristic of the ancient Judea Jews, who had emigrated from Egypt prior to their dispersal throughout the Mediterranean Basin and Europe[7] on the basis of high R0 percentages among Sephardi and Ashkenazi Jews compared to native European populations and the relative genetic isolation of Ashkenazim. However, more recent studies have found R0 frequencies as low as 24.3% among some Afroasiatic-speaking groups in the Horn of Africa,[8] as well as higher R0 frequencies among certain other Afroasiatic speakers in North Africa (37.3%)[9] and among some Palestinians in the Levant (30.4%).[10] On the contrary, at a frequency of 47.2% of the population of Basque country having the lack of the D antigen, these people display the highest frequency of the Rh negative phenotype.[11]
| Phenotype expressed on cell | Genotype expressed in DNA | Prevalence (%) |
|
|---|---|---|---|
| Fisher–Race notation | Wiener notation | ||
| D+ C+ E+ c+ e+ (RhD+) | Dce/DCE | R0RZ | 0.0125 |
| Dce/dCE | R0rY | 0.0003 | |
| DCe/DcE | R1R2 | 11.8648 | |
| DCe/dcE | R1r″ | 0.9992 | |
| DcE/dCe | R2r′ | 0.2775 | |
| DCE/dce | RZr | 0.1893 | |
| D+ C+ E+ c+ e− (RhD+) | DcE/DCE | R2RZ | 0.0687 |
| DcE/dCE | R2rY | 0.0014 | |
| DCE/dcE | RZr″ | 0.0058 | |
| D+ C+ E+ c− e+ (RhD+) | DCe/dCE | R1rY | 0.0042 |
| DCE/dCe | RZr′ | 0.0048 | |
| DCe/DCE | R1RZ | 0.2048 | |
| D+ C+ E+ c− e− (RhD+) | DCE/DCE | RZRZ | 0.0006 |
| DCE/dCE | RZrY | < 0.0001 | |
| D+ C+ E− c+ e+ (RhD+) | Dce/dCe | R0r′ | 0.0505 |
| DCe/dce | R1r | 32.6808 | |
| DCe/Dce | R1R0 | 2.1586 | |
| D+ C+ E− c− e+ (RhD+) | DCe/DCe | R1R1 | 17.6803 |
| DCe/dCe | R1r′ | 0.8270 | |
| D+ C− E+ c+ e+ (RhD+) | DcE/Dce | R2R0 | 0.7243 |
| Dce/dcE | R0r″ | 0.0610 | |
| DcE/dce | R2r | 10.9657 | |
| D+ C− E+ c+ e− (RhD+) | DcE/DcE | R2R2 | 1.9906 |
| DcE/dcE | R2r″ | 0.3353 | |
| D+ C− E− c+ e+ (RhD+) | Dce/Dce | R0R0 | 0.0659 |
| Dce/dce | R0r | 1.9950 | |
| D− C+ E+ c+ e+ (RhD−) | dce/dCE | rrY | 0.0039 |
| dCe/dcE | r′r″ | 0.0234 | |
| D− C+ E+ c+ e− (RhD−) | dcE/dCE | r″rY | 0.0001 |
| D− C+ E+ c− e+ (RhD−) | dCe/dCE | r′rY | 0.0001 |
| D− C+ E+ c− e− (RhD−) | dCE/dCE | rYrY | < 0.0001 |
| D− C+ E− c+ e+ (RhD−) | dce/dCe | rr′ | 0.7644 |
| D− C+ E− c− e+ (RhD−) | dCe/dCe | r′r′ | 0.0097 |
| D− C− E+ c+ e+ (RhD−) | dce/dcE | rr″ | 0.9235 |
| D− C− E+ c+ e− (RhD−) | dcE/dcE | r″r″ | 0.0141 |
| D− C− E− c+ e+ (RhD−) | dce/dce | rr | 15.1020 |
• Figures taken from a study performed in 1948 on a sample of 2000 people in the United Kingdom.[12]
| Rh Phenotype | CDE | Patients (%) | Donors (%) |
|---|---|---|---|
| R1r | CcDe | 37.4 | 33.0 |
| R1R2 | CcDEe | 35.7 | 30.5 |
| R1R1 | CDe | 5.7 | 21.8 |
| rr | ce | 10.3 | 11.6 |
| R2r | cDEe | 6.6 | 10.4 |
| R0R0 | cDe | 2.8 | 2.7 |
| R2R2 | cDE | 2.8 | 2.4 |
| rr″ | cEe | – | 0.98 |
| RZRZ | CDE | – | 0.03 |
| rr′ | Cce | 0.8 | – |
Rh antibodies[edit]
Rh antibodies are Immunoglobulin G (IgG) antibodies which are acquired through exposure to Rh-positive blood (generally either through pregnancy or transfusion of blood products). The D antigen is the most immunogenic of all the non-ABO antigens. Approximately 80% of individuals who are D-negative and exposed to a single D-positive unit will produce an anti-D antibody. The percentage of alloimmunization is significantly reduced in patients who are actively exsanguinating.[14]
All Rh antibodies except D display dosage (antibody reacts more strongly with red cells homozygous for an antigen than cells heterozygous for the antigen (EE stronger reaction vs Ee).
If anti-E is detected, the presence of anti-c should be strongly suspected (due to combined genetic inheritance). It is therefore common to select c-negative and E-negative blood for transfusion patients who have an anti-E and lack the c antigen (in general, a patient will not produce antibodies against their own antigens). Anti-c is a common cause of delayed hemolytic transfusion reactions.[15]
Hemolytic disease of the newborn[edit]
The hemolytic condition occurs when there is an incompatibility between the blood types of the mother and fetus. There is also potential incompatibility if the mother is Rh negative and the father is positive. When any incompatibility is detected, the mother often receives an injection at 28 weeks gestation and at birth to avoid the development of antibodies towards the fetus. These terms do not indicate which specific antigen-antibody incompatibility is implicated. The disorder in the fetus due to Rh D incompatibility is known as erythroblastosis fetalis.
- Hemolytic comes from two words: «hema» (blood) and «lysis» (solution) or breaking down of red blood cells
- Erythroblastosis refers to the making of immature red blood cells
- Fetalis refers to the fetus.
When the condition is caused by the Rh D antigen-antibody incompatibility, it is called Rh D Hemolytic disease of the newborn or Rh disease. Here, sensitization to Rh D antigens (usually by feto-maternal transfusion during pregnancy) may lead to the production of maternal IgG anti-D antibodies which can pass through the placenta. This is of particular importance to D negative females at or below childbearing age, because any subsequent pregnancy may be affected by the Rh D hemolytic disease of the newborn if the baby is D positive. The vast majority of Rh disease is preventable in modern antenatal care by injections of IgG anti-D antibodies (Rho(D) Immune Globulin). The incidence of Rh disease is mathematically related to the frequency of D negative individuals in a population, so Rh disease is rare in old-stock populations of Africa and the eastern half of Asia, and the Indigenous peoples of Oceania and the Americas, but more common in other genetic groups, most especially Western Europeans, but also other West Eurasians, and to a lesser degree, native Siberians, as well as those of mixed-race with a significant or dominant descent from those (e.g. the vast majority of Latin Americans and Central Asians).
- Symptoms and signs in the fetus:
- Enlarged liver, spleen, or heart and fluid buildup in the fetus’ abdomen seen via ultrasound.
- Symptoms and signs in the newborn:
- Anemia that creates the newborn’s pallor (pale appearance).
- Jaundice or yellow discoloration of the newborn’s skin, sclera or mucous membrane. This may be evident right after birth or after 24–48 hours after birth. This is caused by bilirubin (one of the end products of red blood cell destruction).
- Enlargement of the newborn’s liver and spleen.
- The newborn may have severe edema of the entire body.
- Dyspnea (difficulty breathing)
Other animals with Rh-like antigens causing hemolytic disease of the newborn
Rh disease only occurs in human fetuses however a similar disease called Neonatal isoerythrolysis (NI) can be observed in animal species of newborn horses, mules, pigs, cats, cattle, and dogs. What differs between Rh disease and NI is the pathogenesis of hemolysis between human fetuses and the animal species. With human mothers, the maternal antibodies are formed from the sensitization of foreign antigens of her unborn fetus’s red blood cells passing through the placenta causing hemolysis before birth, with other animals however, these maternal antibodies are not passed through the placenta but through colostrum. The newborn animal is without NI but soon develops hemolytic anemia after initial ingestion of its mother’s colostrum that contain antibodies that can be absorbed through the newborn’s intestines and are incompatible to its red blood cell antigen. After 48 hours of birth, the newborn may be allowed to nurse from its mother as her antibodies can no longer be absorbed through the neonate’s intestines. Because the most active newborn animals consume the most colostrum, they may be the ones who are most affected by the blood incompatibility of antigen and antibody.[16]
Rh proteins outside of human species
Rh molecules can be found in many different living organisms from worms, bacteria, algae, and other vertebrates. These Rh molecules from different animals have the same biochemical function-differing slightly in their amino acid sequences.[17] The Rh proteins in other species, however, do not correspond with the Rh blood group or antigens found on human red blood cells. One such example would be the nematode Caenorhabditis elegans. Because this worm does not have red blood cells, it cannot have Rh antigens, excluding it from having a Rh blood type. These Rh proteins therefore do not bind to red blood cells; they operate independently. Instead of transporting CO2 from the proteins of human red blood cells, C. elegan’s Rh proteins transport NH3 out of its body.[18]
Population data[edit]
According to a comprehensive study, the worldwide frequency of Rh-positive and Rh-negative blood types is approximately 94% and 6%, respectively. The same study concluded that the share of the population with Rh-negative blood type is set to fall further in the future primarily due to low population growth in Europe.[19] The frequency of Rh factor blood types and the RhD neg allele gene differs in various populations.[citation needed]
| Population | Rh(D) Neg | Rh(D) Pos | Rh(D) Neg alleles |
|---|---|---|---|
| African Americans | ∼ 7% | 93% | ∼ 26% |
| Albania[21] | 10.86% | 89% | weak D 1.4% |
| Basques[22] | 21%–36% | 65% | ∼ 60% |
| Britain[23] | 17% | 83% | |
| China[23] | < 1% | > 99% | |
| Ethiopians[23] | 1%–21% | 99%–79% | |
| Europeans (others) | 16% | 84% | 40% |
| India[23] | 0.6%–8.4% | 99.4%–91.6% | |
| Indonesia[23] | < 1% | > 99% | |
| Japan[23] | < 1% | > 99% | |
| Koreans[24] | < 1% | > 99% | |
| Madagascar[23] | 1% | 99% | |
| Moroccans[25] | 9.5% | 90.5% | |
| Moroccans (High Atlas)[26] | ∼ 29% | 71% | |
| Native Americans | ∼ 1% | 99% | ∼ 10% |
| Nigeria[27] | 6% | 94% | |
| Saudi Arabia[28] | 8.8% | 91.2% | 29.5% |
| Subequatorial Africa[23] | 1%–3% | 99%–97% | |
| United States[23] | 15% | 85% |
Genetics[edit]
This is a Punnett square for Rh factor inheritance. This square specifically shows two heterozygous Rh positive parents and the possible genotypes/phenotypes the offspring could have.
The D antigen is inherited as one gene (RHD) (on the short arm of the first chromosome, p36.13–p34.3) with various alleles. Typically, Rhesus positive people have an intact RHD gene while negative people lack the gene (or have mutations in it). However, there are exceptions: for instance, Japanese and black Africans may have an intact gene that is not expressed or only at very low levels.[29] The gene codes for the RhD protein on the red blood cell membrane. D− individuals who lack a functional RHD gene do not produce the D antigen, and may be immunized by D+ blood.[citation needed]
The D antigen is a dominant trait. If both of a child’s parents are Rh negative, the child will definitely be Rh negative. Otherwise the child may be Rh positive or Rh negative, depending on the parents’ specific genotypes.[30]
The epitopes for the next 4 most common Rh antigens, C, c, E and e are expressed on the highly similar RhCE protein that is genetically encoded in the RHCE gene, also found on chromosome 1. It has been shown that the RHD gene arose by duplication of the RHCE gene during primate evolution. Mice have just one RH gene.[31]
The RHAG gene, which is responsible for encoding Rh-associated glycoprotein (RhAG), is found on chromosome 6a.
The polypeptides produced from the RHD and RHCE genes form a complex on the red blood cell membrane with the Rh-associated glycoprotein.[15]
Function[edit]
| Blood group Rh C/E/D polypeptide | |
|---|---|
| Identifiers | |
| Symbol | ? |
| InterPro | IPR002229 |
On the basis of structural homology it has been proposed that the product of RHD gene, the RhD protein, is a membrane transport protein of uncertain specificity (CO2 or NH3) and unknown physiological role.[32][33] The three-dimensional structure of the related RHCG protein and biochemical analysis of the RhD protein complex indicates that the RhD protein is one of three subunits of an ammonia transporter.[34][35] Three recent studies[36][37][38] have reported a protective effect of the RhD-positive phenotype, especially RhD heterozygosity, against the negative effect of latent toxoplasmosis on psychomotor performance in infected subjects. RhD-negative compared to RhD-positive subjects without anamnestic titres of anti-Toxoplasma antibodies have shorter reaction times in tests of simple reaction times. And conversely, RhD-negative subjects with anamnestic titres (i.e. with latent toxoplasmosis) exhibited much longer reaction times than their RhD-positive counterparts. The published data suggested that only the protection of RhD-positive heterozygotes was long term in nature; the protection of RhD-positive homozygotes decreased with duration of the infection while the performance of RhD-negative homozygotes decreased immediately after the infection. The overall change in reaction times was always larger in the RhD-negative group than in the RhD-positive.[citation needed]
RHD polymorphism[edit]
Origin of RHD polymorphism[edit]
For a long time, the origin of RHD polymorphism was an evolutionary enigma.[39][40][41] Before the advent of modern medicine, the carriers of the rarer allele (e.g. RhD-negative women in a population of RhD positives or RhD-positive men in a population of RhD negatives) were at a disadvantage as some of their children (RhD-positive children born to preimmunised RhD-negative mothers) were at a higher risk of fetal or newborn death or health impairment from hemolytic disease.[citation needed]
Natural selection aside, the RHD-RHCE region is structurally predisposed to many mutations seen in humans, since the pair arose by gene duplication and remain similar enough for unequal crossing over to occur.[31] In addition to the case where D is deleted, crossover can also produce a single gene mixing exons from both RHD and RHCE, forming the majority of partial D types.[42]: 323
Weak D[edit]
| Weak D | Partial D | |
|---|---|---|
| Change in D | Decreased amount | Structural alternation |
| Can donate as if being: |
D positive | D positive |
| Can receive blood as if being: |
D positive (usually)[42] | D negative[15] |
In serologic testing, D positive blood is easily identified. Units that are D negative are often retested to rule out a weaker reaction. This was previously referred to as Du, which has been replaced.[42]: 322 By definition, weak D phenotype is characterized by negative reaction with anti-D reagent at immediate spin (IS), negative reaction after 37 °C incubation, and positive reaction at anti-human globulin (AHG) phase. Weak D phenotype can occur in several ways. In some cases, this phenotype occurs because of an altered surface protein that is more common in people of European descent. An inheritable form also occurs, as a result of a weakened form of the R0 gene. Weak D may also occur as «C in trans», whereby a C gene is present on the opposite chromosome to a D gene (as in the combination R0r’, or «Dce/dCe»). The testing is difficult, since using different anti-D reagents, especially the older polyclonal reagents, may give different results.
The practical implication of this is that people with this sub-phenotype will have a product labeled as «D positive» when donating blood. When receiving blood, they are sometimes typed as a «D negative», though this is the subject of some debate. Most «Weak D» patients can receive «D positive» blood without complications.[42]: 323 However, it is important to correctly identify the ones that have to be considered D+ or D−. This is important, since most blood banks have a limited supply of «D negative» blood and the correct transfusion is clinically relevant. In this respect, genotyping of blood groups has much simplified this detection of the various variants in the Rh blood group system.
Partial D[edit]
It is important to differentiate weak D (due to a quantitative difference in the D antigen) from partial D (due to a qualitative difference in the D antigen). Simply put, the weak D phenotype is due to a reduced number of D antigens on a red blood cell. In contrast, the partial D phenotype is due to an alteration in D-epitopes. Thus, in partial D, the number of D antigens is not reduced but the protein structure is altered. These individuals, if alloimmunized to D, can produce an anti-D antibody. Therefore, partial D patients who are donating blood should be labeled as D-positive but, if receiving blood, they should be labeled as D-negative and receive D-negative units.[15]
In the past, partial D was called ‘D mosaic’ or ‘D variant.’ Different partial D phenotypes are defined by different D epitopes on the outer surface of the red blood cell membrane. More than 30 different partial D phenotypes have been described.[15]
Rhnull phenotype[edit]
Rhnull individuals have no Rh antigens (no Rh or RhAG) on their red blood cells.[43] This rare condition[43] has been called «Golden Blood».[44] As a consequence of Rh antigen absence, Rhnull red blood cells also lack LW and Fy5 and show weak expression of S, s, and U antigens.
Red blood cells lacking Rh/RhAG proteins have structural abnormalities (such as stomatocytosis) and cell membrane defects that can result in hemolytic anemia.[15][43]
The first Rhnull blood was discovered in an Aboriginal Australian woman, in 1961.[45] Only 43 individuals have been reported to have it worldwide. Only nine active donors have been reported.[44] Its properties make it attractive in numerous medical applications, but scarcity makes it expensive to transport and acquire.[46]
Other Rh group antigens[edit]
Currently, 50 antigens have been described in the Rh group system; among those described here, the D, C, c, E and e antigens are the most important. The others are much less frequently encountered or are rarely clinically significant. Each is given a number, though the highest assigned number (CEVF or RH61 according to the ISBT terminology) is not an accurate reflection of the antigens encountered since many (e.g. Rh38) have been combined, reassigned to other groups, or otherwise removed.[42]: 324
Some of the other Rh «antigens» are f («ce», RH6), Ce (RH7), Cw (RH8), Cx (RH9), V (RH10), Ew (RH11), G (RH12), Tar (RH40), VS (RH20), Dw (RH23), and CE (RH22). Some of these groups, including f, Ce and CE, describe grouping of some existing groups. Others, like V, describe an epitope created by some other mutation on the RHD and RHCE genes. V in particular is caused by a mutation on RHCE.[47]
History[edit]
The term «Rh» was originally an abbreviation of «Rhesus factor». It was discovered in 1937 by Karl Landsteiner and Alexander S. Wiener, who, at the time, believed it to be a similar antigen found in rhesus macaque red blood cells. It was subsequently discovered that the human factor is not identical to the rhesus monkey factor, but by then, «Rhesus Group» and like terms were already in widespread, worldwide use. Thus, notwithstanding it is a misnomer, the term survives (e.g., rhesus blood group system and the obsolete terms rhesus factor, rhesus positive, and rhesus negative – all three of which actually refer specifically and only to the Rh D factor and are thus misleading when unmodified). Contemporary practice is to use «Rh» as a term of art instead of «Rhesus» (e.g., «Rh Group», «Rh factors», «Rh D», etc.).
The significance of their discovery was not immediately apparent and was only realized in 1940, after subsequent findings by Philip Levine and Rufus Stetson.[48] The serum that led to the discovery was produced by immunizing rabbits with red blood cells from a rhesus macaque. The antigen that induced this immunization was designated by them as Rh factor to indicate that rhesus blood had been used for the production of the serum.[49]
In 1939, Phillip Levine and Rufus Stetson published in a first case report the clinical consequences of non-recognized Rh factor, hemolytic transfusion reaction, and hemolytic disease of the newborn in its most severe form.[50] It was recognized that the serum of the reported woman agglutinated with red blood cells of about 80% of the people although the then known blood groups, in particular ABO were matched. No name was given to this agglutinin when described. In 1940, Karl Landsteiner and Alexander S. Wiener made the connection to their earlier discovery, reporting a serum that also reacted with about 85% of different human red blood cells.[51]
In 1941, Group O: a patient of Dr. Paul in Irvington, NJ, delivered a normal infant in 1931; this pregnancy was followed by a long period of sterility. The second pregnancy (April, 1941) resulted in an infant with icterus gravis.[52] In May 1941, the third anti-Rh serum (M.S.) of Group O became available.[52]
Based on the serologic similarities, Rh factor was later also used for antigens, and anti-Rh for antibodies, found in humans such as those previously described by Levine and Stetson. Although differences between these two sera were shown already in 1942 and clearly demonstrated in 1963, the already widely used term «Rh» was kept for the clinically described human antibodies which are different from the ones related to the rhesus monkey. This real factor found in rhesus macaque was classified in the Landsteiner-Weiner antigen system (antigen LW, antibody anti-LW) in honor of the discoverers.[53][54]
It was recognized that the Rh factor was just one in a system of various antigens. Based on different models of genetic inheritance, two different terminologies were developed; both of them are still in use.
The clinical significance of this highly immunizing D antigen (i.e., Rh factor) was soon realized. Some keystones were to recognize its importance for blood transfusion (including reliable diagnostic tests), hemolytic disease of the newborn (including exchange transfusion), and very importantly the prevention of it by screening and prophylaxis.
The discovery of fetal cell-free DNA in maternal circulation by Holzgrieve et al. led to the noninvasive genotyping of fetal Rh genes in many countries.
References[edit]
- ^ Dean, Laura. Blood Groups and Red Cell Antigens [Internet].. Bethesda (MD): National Center for Biotechnology Information (US); 2005, Chapter. 7.
- ^ «Rh System». Canadian Blood Services at learnserology.ca. Retrieved 2021-01-19.
- ^ Weiner AS (1 February 1949). «Genetics and Nomenclature of the Rh–Hr Blood Types». Antonie van Leeuwenhoek. 15 (1): 17–28. doi:10.1007/BF02062626. ISSN 0003-6072. S2CID 35680084.
- ^ «dbRBC – Blood Group Antigen Gene Mutation Database». www.ncbi.nlm.nih.gov. Archived from the original on 2011-02-13. Retrieved 2010-06-15.
- ^ «RHD Rh blood group, D antigen [Homo sapiens] – Gene Result». nlm.nih.gov. Retrieved 2010-06-15.
- ^ «RHCE Rh blood group, CcEe antigens [Homo sapiens] – Gene Result». nlm.nih.gov. Archived from the original on 2010-03-20. Retrieved 2010-06-15.
- ^ Ottensooser F, Leon N, Sato M, Saldanha PH (March 1963). «Blood groups of a population of Ashkenazi Jews in Brazil». American Journal of Physical Anthropology. 21 (1): 41–8. doi:10.1002/ajpa.1330210106. PMID 13940710. S2CID 21795826.
- ^ Harrison GA, Küchemann CF, Moore MA, Boyce AJ, Baju T, Mourant AE, et al. (1969). «The effects of altitudinal variation in Ethiopian populations». Philosophical Transactions of the Royal Society of London B: Biological Sciences. 256 (805): 147–182. Bibcode:1969RSPTB.256..147H. doi:10.1098/rstb.1969.0040.
- ^ Metri AA, Sidi-Yakhlef A, Biémont C, Saidi M, Chaif O, Ouraghi SA (2012). «A genetic study of nine populations from the region of Tlemcen in Western Algeria: a comparative analysis on the Mediterranean scale». Anthropological Science. 120 (3): 209–216. doi:10.1537/ase.120618. Archived from the original on 29 August 2017. Retrieved 28 August 2017.
- ^ El-Wahhab Skaik YA (July 2011). «The Rh allele frequencies in Gaza city in Palestine». Asian Journal of Transfusion Science. 5 (2): 150–2. doi:10.4103/0973-6247.83241. PMC 3159245. PMID 21897594.
- ^ Flores-Bello A, Mas-Ponte D, Rosu ME, Bosch E, Calafell F, Comas D (December 2018). «Sequence diversity of the Rh blood group system in Basques». European Journal of Human Genetics. 26 (12): 1859–1866. doi:10.1038/s41431-018-0232-1. PMC 6244411. PMID 30089826.
- ^ Race RR, Mourant AE (June 1948). «The Rh chromosome frequencies in England». Blood. 3 (6): 689–95. doi:10.1182/blood.V3.6.689.689. PMID 18860341.
- ^ Canatan D, Acar N, Kiliç B (1999). «Rh Subgroups and Kell Antigens in Patients With Thalassemia and in Donors in Turkey» (PDF). Turkish Journal of Medical Sciences. 29: 155–7. Archived from the original (PDF) on 2008-12-17. Retrieved 2008-10-17.
- ^ Roback et al. AABB Technical Manual, 16th Ed. Bethesda, AABB Press, 2008.
- ^ a b c d e f Mais, DD. ASCP Quick Compendium of Clinical Pathology, 2nd Ed. Chicago, ASCP Press, 2009.
- ^ Cotter S (June 1, 2001). Hematology. Quick Look Series (1st ed.). Teton NewMedia. pp. 32–33. ISBN 978-1893441361.
- ^ Ji Q, Hashmi S, Liu Z, Zhang J, Chen Y, Huang CH (April 2006). «CeRh1 (rhr-1) is a dominant Rhesus gene essential for embryonic development and hypodermal function in Caenorhabditis elegans». Proceedings of the National Academy of Sciences of the United States of America. 103 (15): 5881–5886. doi:10.1073/pnas.0600901103. PMC 1458667. PMID 16595629.
- ^ «What is Rhesus factor? Did we get it from Rhesus monkeys? Can Rh factor be found in other animals?». The Tech Interactive. 2018-11-20. Retrieved 2022-10-24.
- ^ «Blood Type Frequencies by Country including the Rh Factor – Rhesus Negative».
- ^ Mack S (March 21, 2001). «Re: Is the RH negative blood type more prevalent in certain ethnic groups?». MadSci Network. Archived from the original on February 24, 2011.
- ^ Xhetani M, Seferi I, Férec C, Zoraqi G, Fichou Y (October 2014). «Distribution of Rhesus blood group antigens and weak D alleles in the population of Albania». Blood Transfusion = Trasfusione del Sangue. 12 (4): 565–9. doi:10.2450/2014.0240-13. PMC 4212038. PMID 24960662.
- ^ Touinssi M, Chiaroni J, Degioanni A, De Micco P, Dutour O, Bauduer F (2004). «Distribution of rhesus blood group system in the French basques: a reappraisal using the allele-specific primers PCR method». Human Heredity. 58 (2): 69–72. doi:10.1159/000083027. PMID 15711086. S2CID 44542508.
- ^ a b c d e f g h i Golassa L, Tsegaye A, Erko B, Mamo H (July 2017). «High rhesus (Rh(D)) negative frequency and ethnic-group based ABO blood group distribution in Ethiopia». BMC Research Notes. 10 (1): 330. doi:10.1186/s13104-017-2644-3. PMC 5530478. PMID 28747227.
- ^ Kim JY, Kim SY, Kim CA, Yon GS, Park SS (March 2005). «Molecular characterization of D- Korean persons: development of a diagnostic strategy». Transfusion. 45 (3): 345–52. doi:10.1111/j.1537-2995.2005.04311.x. PMID 15752151. S2CID 42899178.
- ^ Wafi ME, Housse HE, Nourichafi N, Bouisk K, Benajiba M, Habti N (2016). «Prevalence of weak D phenotype among D negative C/E+ blood donors in Morocco» (PDF). International Journal of Blood Transfusion and Immunohematology. 6 (1): 3–7. doi:10.5348/ijbti-2016-22-OA-2. Archived (PDF) from the original on August 28, 2016. Retrieved February 3, 2018.
- ^ Weinstock C (January 2014). «It is worthwhile filling in the remaining blank spots for blood group antigen frequencies». Blood Transfusion = Trasfusione del Sangue. 12 (1): 3–6. doi:10.2450/2013.0192-13. PMC 3926725. PMID 24120599.
- ^ Enosolease ME, Bazuaye GN (January 2008). «Distribution of ABO and Rh-D blood groups in the Benin area of Niger-Delta: Implication for regional blood transfusion». Asian Journal of Transfusion Science. 2 (1): 3–5. doi:10.4103/0973-6247.39502. PMC 2798756. PMID 20041069.
- ^ Eweidah MH, Rahiman S, Ali MH, Al-Shamary AM (April 2011). «Distribution of ABO and Rhesus (RHD) Blood Groups in Al-Jouf Province of the Saudi Arabia» (PDF). The Anthropologist. 13 (2): 99–102. doi:10.1080/09720073.2011.11891182. S2CID 75537061. Archived (PDF) from the original on January 2, 2013. Retrieved February 3, 2018.
- ^ Avent ND, Reid ME (January 2000). «The Rh blood group system: a review». Blood. 95 (2): 375–387. doi:10.1182/blood.V95.2.375. PMID 10627438. S2CID 13803474.
- ^ «ABO inheritance patterns». Inheritance patterns of blood groups. Australian Red Cross Blood Service. Archived from the original on 1 November 2013. Retrieved 30 October 2013.
- ^ a b Wagner FF, Flegel WA (March 2002). «RHCE represents the ancestral RH position, while RHD is the duplicated gene». Blood. 99 (6): 2272–3. doi:10.1182/blood-2001-12-0153. PMID 11902138.
- ^ Kustu S, Inwood W (2006). «Biological gas channels for NH3 and CO2: evidence that Rh (Rhesus) proteins are CO2 channels». Transfusion Clinique et Biologique. 13 (1–2): 103–10. doi:10.1016/j.tracli.2006.03.001. PMID 16563833.
- ^ Biver S, Scohy S, Szpirer J, Szpirer C, André B, Marini AM (2006). «Physiological role of the putative ammonium transporter RhCG in the mouse». Transfusion Clinique et Biologique. 13 (1–2): 167–8. doi:10.1016/j.tracli.2006.03.003. PMID 16564721.
- ^ Gruswitz F, Chaudhary S, Ho JD, Schlessinger A, Pezeshki B, Ho CM, et al. (May 2010). «Function of human Rh based on structure of RhCG at 2.1 A». Proceedings of the National Academy of Sciences of the United States of America. 107 (21): 9638–43. Bibcode:2010PNAS..107.9638G. doi:10.1073/pnas.1003587107. PMC 2906887. PMID 20457942.
- ^ Westhoff CM (January 2007). «The structure and function of the Rh antigen complex». Seminars in Hematology. 44 (1): 42–50. doi:10.1053/j.seminhematol.2006.09.010. PMC 1831834. PMID 17198846.
- ^ Novotná M, Havlícek J, Smith AP, Kolbeková P, Skallová A, Klose J, et al. (September 2008). «Toxoplasma and reaction time: role of toxoplasmosis in the origin, preservation and geographical distribution of Rh blood group polymorphism». Parasitology. 135 (11): 1253–61. doi:10.1017/S003118200800485X. PMID 18752708. S2CID 5956901.
- ^ Flegr J, Novotná M, Lindová J, Havlícek J (August 2008). «Neurophysiological effect of the Rh factor. Protective role of the RhD molecule against Toxoplasma-induced impairment of reaction times in women» (PDF). Neuro Endocrinology Letters. 29 (4): 475–81. PMID 18766148.
- ^ Flegr J, Klose J, Novotná M, Berenreitterová M, Havlícek J (May 2009). «Increased incidence of traffic accidents in Toxoplasma-infected military drivers and protective effect RhD molecule revealed by a large-scale prospective cohort study». BMC Infectious Diseases. 9: 72. doi:10.1186/1471-2334-9-72. PMC 2692860. PMID 19470165.
- ^ Haldane JB (1942). «Selection against heterozygosis in Man». Annals of Eugenics. 11: 333–340. doi:10.1111/j.1469-1809.1941.tb02297.x.
- ^ Fisher RA, Race RR, Taylor GL (1944). «Mutation and the Rhesus reaction». Nature. 153 (3873): 106. Bibcode:1944Natur.153..106F. doi:10.1038/153106b0. S2CID 2104065.
- ^ Li CC (1953). «Is the Rh facing a crossroad? A critique of the compensation effect». Am Nat. 87 (835): 257–261. doi:10.1086/281782. S2CID 84715943.
- ^ a b c d e Brecher ME (2005). Technical Manual (15th ed.). Bethesda MD: American Association of Blood Banks. ISBN 978-1-56395-196-1.
- ^ a b c Cartron JP (December 1999). «RH blood group system and molecular basis of Rh-deficiency». Bailliere’s Best Practice & Research. Clinical Haematology. 12 (4): 655–89. doi:10.1053/beha.1999.0047. PMID 10895258.
- ^ a b «Rhnull, the Rarest Blood Type on Earth, Has Been Called the «Golden Blood»«. Curiosity.com. Archived from the original on 5 December 2019. Retrieved 2019-06-05.
- ^ «J-STAGE».
- ^ Bailey P. «The man with the golden blood». Mosaic Science. Retrieved 16 January 2019.
- ^ «Rh System: Anti-V». Professional Education. 2 October 2019. Archived from the original on 7 November 2020.
- ^ Landsteiner K, Wiener AS (1940). «An Agglutinable Factor in Human Blood Recognized by Immune Sera for Rhesus Blood». Exp Biol Med (Maywood). 43 (1): 223. doi:10.3181/00379727-43-11151. S2CID 58298368.
- ^ Landsteiner K, Wiener AS (September 1941). «Studies on an agglutinogen (Rh) in human blood reacting with anti-rhesus sera and with human isoantibodies». The Journal of Experimental Medicine. 74 (4): 309–20. doi:10.1084/jem.74.4.309. PMC 2135190. PMID 19871137.
- ^ Levine P, Stetson RE (1939). «An unusual case of intragroup agglutination». JAMA. 113 (2): 126–7. doi:10.1001/jama.1939.72800270002007a.
- ^ Landsteiner K, Wiener AS (1940). «An agglutinable factor in human blood recognized by immune sera for rhesus blood». Proc Soc Exp Biol Med. 43: 223–4. doi:10.3181/00379727-43-11151. S2CID 58298368.
- ^ a b Levine P, Burnham L, Katzin E, Vogel P (December 1941). «The role of iso-immunization in the pathogenesis of erythroblastosis fetalis». American Journal of Obstetrics and Gynecology. 42 (6): 925–937. doi:10.1016/S0002-9378(41)90260-0. ISSN 0002-9378.
- ^ Avent ND, Reid ME (January 2000). «The Rh blood group system: a review». Blood. 95 (2): 375–87. doi:10.1182/blood.V95.2.375. PMID 10627438. S2CID 13803474.
- ^ Scott ML (July 2004). «The complexities of the Rh system». Vox Sanguinis. 87 (Suppl. 1): 58–62. doi:10.1111/j.1741-6892.2004.00431.x. PMID 15200606. S2CID 42103877.
External links[edit]
- Rh at BGMUT Blood Group Antigen Gene Mutation Database at NCBI, NIH
https://ria.ru/20220119/rezus-faktor-1768596550.html
Резус-фактор: что такое и зачем его определять будущим родителям
Резус фактор крови человека: положительный и отрицательный
Резус-фактор: что такое и зачем его определять будущим родителям
Свою группу крови, как и резус-фактор, необходимо знать каждому человеку. Почему определение положительной или отрицательной резус-принадлежности так важно, что РИА Новости, 15.09.2022
2022-01-19T18:38
2022-01-19T18:38
2022-09-15T21:02
общество
кровь
здоровье — общество
здоровье
донорство
/html/head/meta[@name=’og:title’]/@content
/html/head/meta[@name=’og:description’]/@content
https://cdnn21.img.ria.ru/images/07e6/01/13/1768596406_0:90:3324:1960_1920x0_80_0_0_3cd27f21e7156c3d7ff326afd48bea2d.jpg
МОСКВА, 19 янв — РИА Новости. Свою группу крови, как и резус-фактор, необходимо знать каждому человеку. Почему определение положительной или отрицательной резус-принадлежности так важно, что это такое, чем опасен резус-конфликт для беременных и к каким последствиям он может привести — в материале РИА Новости.Резус фактор»Резус-фактор (Rh-фактор), как и группа крови — это особые белки на поверхности клеток крови (основной антиген D, выделяют еще С, с, Е, е). Если этих белков нет, то резус-фактор считается отрицательным. Стоит отметить, что современная медицина не ограничивается разделением крови на четыре группы и два резус фактора, это лишь две системы признаков из более сорока существующих», — поясняет Кирилл Ювченко, медицинский директор цифровой лаборатории Lifetime+.ПоложительныйЕсли в крови эритроциты (красные клетки крови) несут антиген (белки D), значит резус-фактор у человека положительный (Rh+). Он отмечается у 85% населения планеты. Антиген D (резус-фактор) отличают выраженные иммуногенные свойства (способность провоцировать выработку антител в организме реципиента (тот, кому переливают кровь).ОтрицательныйЕсли антигена D нет, то резус-фактор отрицательный (Rh-). С отсутствием особых белков в крови живет 15% населения в мире.Принадлежность крови человека к определенной системе “резус” является генетически обусловленной и не меняется в течение жизни.Как определяетсяПо словам эксперта, для определения наличия или отсутствия белков “резус-фактор” в крови человека проводится лабораторное исследование. Оно называется “тест на резус-принадлежность” или “группа крови — резус-фактор”. Для анализа берут кровь из вены.При подготовке к процедуре специальных условий нет. Но специалисты отмечают, что при сдаче анализов крови желательно:Где сдать анализСдать кровь и узнать свой резус-фактор бесплатно при наличии полиса ОМС и направления терапевта можно в государственных поликлиниках. Определение резус-фактора крови важно при планируемой беременности, перед хирургическим вмешательством, в случаях, когда может потребоваться переливание эритроцитарной массы.Обозначения в расшифровке анализа кровиНаличие или отсутствие резус-фактора обозначают знаками плюс (Rh+) и минус (Rh-). Возможные результаты в сочетании с группой крови в системе АВ0 указаны в таблице:Риск для женщинКирилл Ювченко акцентирует внимание на том, что женщинам с отрицательным резус-фактором важно следить за совместимостью резус-факторов с плодом с момента зачатия и до рождения ребенка.Резус-фактор и беременностьЕсли у женщины положительный резус-фактор, то отрицательный резус мужчины никак не повлияет на протекание беременности. Даже в случае если ребенок унаследует кровь отца, в его крови не будет «незнакомых» для иммунной системы матери белков, конфликт не возникнет и беременность пройдет без осложнений.А вот у резус-отрицательной будущей мамы и резус-положительного папы есть вероятность, что ребенок будет иметь положительный резус-фактор. В этом случае возникнет резус-конфликт. Специалист отмечает, что при первой беременности он обычно не так активно проявляется, а вот при вторых родах вероятность конфликта высокая, так как в крови резус-отрицательной мамы могут быть антитела.Это позволит предупредить:СовместимостьСовместимость резус-фактора крови матери и плода влияет на последующие девять месяцев внутриутробной жизни. Анализ на определение резус-фактора при беременности назначается при постановке на учет в женской консультации.Также эти данные крайне важны при переливании крови. Если кровь донора (того, кто сдает) и кровь реципиента (того, кому ее вливают) окажется несовместимой, то это грозит пациенту серьезными осложнениями.Причиной несовместимости может служить не только резус крови, но и группа. Основная классификация групп крови по системе АВ0 отражена в таблице:В некоторых случаях возможна несовместимость по крови у мамы и ребенка:У мамы с I (Rh-) кровью возможна реакция на:У мамы с II (Rh-) кровью возможна реакция на:У мамы с III (Rh-) кровью возможна реакция на:У женщин с IV(Rh-) кровью возможен конфликт, который вызывает иммунную реакцию только в случае, если у папы ребенка кровь резус-положительная (Rh+).Резус-конфликт и его причиныЭксперт подчеркивает, если мать уже иммунизирована, то врачи определяют количество антител и проводят процедуру плазмафереза (забор некоторого объема крови) для уменьшения их количества.В случае тяжелых последствий и вынужденного прерывания беременности важно сделать вакцину — антирезус иммуноглобулин в первые 72 часа.Важность при переливании кровиРезус-принадлежность крайне важна при предоперационной подготовке пациента, когда есть вероятность, что понадобится гемотрансфузия (переливание донорской крови).Если пациенту (реципиенту) с отрицательным резус-фактором перельют резус-положительную кровь, то его иммунная система отреагирует на этот антиген как на чужеродный и организм человека запустит выработку антител к нему. Как правило, в таких случаях образуется небольшое число антител, но при этом сохраняются так называемые клетки памяти (В-лимфоциты), которые помнят об антигене D. При повторном контакте с чужеродными эритроцитарными антигенами образуется множество антител, и донорские эритроциты массивно разрушаются.Резус-конфликт при переливании крови вызывает посттрансфузионные осложнения:ПрофилактикаСовременная медицина позволяет контролировать проблему несовместимости по резус-фактору. Женщины с отрицательным резусом во время беременности наблюдаются наиболее тщательно.До восьмого месяца беременности анализ на антитела врач проводит ежемесячно. С 32 недели исследование делают дважды в месяц, а с 36-й — каждую неделю. Это позволяет выявить начало резус-конфликта и после родов ввести специальный антирезусный иммуноглобулин, содержащий особые антитела для связывания антител матери.
https://ria.ru/20210825/gemoglobin-1747256451.html
https://ria.ru/20210924/anemiya-1751712752.html
https://ria.ru/20210820/bilirubin-1746630823.html
РИА Новости
internet-group@rian.ru
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
2022
РИА Новости
internet-group@rian.ru
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
Новости
ru-RU
https://ria.ru/docs/about/copyright.html
https://xn--c1acbl2abdlkab1og.xn--p1ai/
РИА Новости
internet-group@rian.ru
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
https://cdnn21.img.ria.ru/images/07e6/01/13/1768596406_297:0:3028:2048_1920x0_80_0_0_bc4da0563f0437dc7a6896bea31c3040.jpg
РИА Новости
internet-group@rian.ru
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
РИА Новости
internet-group@rian.ru
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
общество, кровь, здоровье — общество, здоровье, донорство
Общество, Кровь, Здоровье — Общество, Здоровье, Донорство
МОСКВА, 19 янв — РИА Новости. Свою группу крови, как и резус-фактор, необходимо знать каждому человеку. Почему определение положительной или отрицательной резус-принадлежности так важно, что это такое, чем опасен резус-конфликт для беременных и к каким последствиям он может привести — в материале РИА Новости.
Резус фактор
«Резус-фактор (Rh-фактор), как и группа крови — это особые белки на поверхности клеток крови (основной антиген D, выделяют еще С, с, Е, е). Если этих белков нет, то резус-фактор считается отрицательным. Стоит отметить, что современная медицина не ограничивается разделением крови на четыре группы и два резус фактора, это лишь две системы признаков из более сорока существующих», — поясняет Кирилл Ювченко, медицинский директор цифровой лаборатории Lifetime+.
Положительный
Если в крови эритроциты (красные клетки крови) несут антиген (белки D), значит резус-фактор у человека положительный (Rh+). Он отмечается у 85% населения планеты. Антиген D (резус-фактор) отличают выраженные иммуногенные свойства (способность провоцировать выработку антител в организме реципиента (тот, кому переливают кровь).
Отрицательный
Если антигена D нет, то резус-фактор отрицательный (Rh-). С отсутствием особых белков в крови живет 15% населения в мире.
Принадлежность крови человека к определенной системе “резус” является генетически обусловленной и не меняется в течение жизни.
Как определяется
По словам эксперта, для определения наличия или отсутствия белков “резус-фактор” в крови человека проводится лабораторное исследование. Оно называется “тест на резус-принадлежность” или “группа крови — резус-фактор”. Для анализа берут кровь из вены.
При подготовке к процедуре специальных условий нет. Но специалисты отмечают, что при сдаче анализов крови желательно:
- избегать пищевых перегрузок;
- сдавать анализ натощак или выдержать четыре часа после приема пищи;
- исключить прием алкоголя накануне процедуры;
- не курить минимум один час до исследования;
- избегать эмоциональных и физических нагрузок.
Где сдать анализ
«
Тест на резус-принадлежность можно сдать в любой независимой лаборатории вместе в анализом на определение группы крови. Стоимость такого исследования зависит от прейскуранта самой клиники. «В тесте при получении результатов не указывают референсные значения, так как их попросту нет. Исследование просто покажет наличие или отсутствие белков «резус-фактор», что не является патологией в обоих случаях», — разъясняет Кирилл Ювченко.
Сдать кровь и узнать свой резус-фактор бесплатно при наличии полиса ОМС и направления терапевта можно в государственных поликлиниках. Определение резус-фактора крови важно при планируемой беременности, перед хирургическим вмешательством, в случаях, когда может потребоваться переливание эритроцитарной массы.
Обозначения в расшифровке анализа крови
Наличие или отсутствие резус-фактора обозначают знаками плюс (Rh+) и минус (Rh-). Возможные результаты в сочетании с группой крови в системе АВ0 указаны в таблице:
|
Группы крови |
Обозначение с учетом наличия D антигена |
Обозначение с учетом отсутствия D антигена |
|
первая (0) |
0 Rh+ |
0 Rh- |
|
вторая (А) |
А Rh+ |
А Rh- |
|
третья (В) |
В Rh+ |
В Rh- |
|
четвертая (АВ) |
АВ Rh+ |
АВ Rh- |
Риск для женщин
Кирилл Ювченко акцентирует внимание на том, что женщинам с отрицательным резус-фактором важно следить за совместимостью резус-факторов с плодом с момента зачатия и до рождения ребенка.
Резус-фактор и беременность
Гемоглобин в крови: причины и последствия отклонения от нормы
Если у женщины положительный резус-фактор, то отрицательный резус мужчины никак не повлияет на протекание беременности. Даже в случае если ребенок унаследует кровь отца, в его крови не будет «незнакомых» для иммунной системы матери белков, конфликт не возникнет и беременность пройдет без осложнений.
А вот у резус-отрицательной будущей мамы и резус-положительного папы есть вероятность, что ребенок будет иметь положительный резус-фактор. В этом случае возникнет резус-конфликт. Специалист отмечает, что при первой беременности он обычно не так активно проявляется, а вот при вторых родах вероятность конфликта высокая, так как в крови резус-отрицательной мамы могут быть антитела.
«
«Чтобы защитить малыша от возможных последствий, женщинам с отрицательным резусом при беременности необходимо вовремя сдавать все анализы, назначаемые врачом», — советует Кирилл Ювченко.
Это позволит предупредить:
- выкидыш;
- водянку плода и отечный синдром;
- эритробластоз (анемия) у малыша;
- нарушения слуха, работы головного мозга и речи ребенка.
Совместимость
Совместимость резус-фактора крови матери и плода влияет на последующие девять месяцев внутриутробной жизни. Анализ на определение резус-фактора при беременности назначается при постановке на учет в женской консультации.
Также эти данные крайне важны при переливании крови. Если кровь донора (того, кто сдает) и кровь реципиента (того, кому ее вливают) окажется несовместимой, то это грозит пациенту серьезными осложнениями.
Причиной несовместимости может служить не только резус крови, но и группа. Основная классификация групп крови по системе АВ0 отражена в таблице:
|
Группы крови |
Описание |
|
I (0) — самая распространенная |
отсутствуют специфические белки и антигенные свойства |
|
II (А) |
в эритроцитарной оболочке присутствует антиген типа А |
|
III (В) |
в клеточной мембране эритроцитов находится антиген типа В |
|
IV (АВ) — самая редкая |
в плазматической оболочке красных кровяных телец содержатся антигены обоих типов, А и В |
В некоторых случаях возможна несовместимость по крови у мамы и ребенка:
У мамы с I (Rh-) кровью возможна реакция на:
- белок II группы (А);
- белок III группы (В);
- белок резуса (положительный).
Железо в крови: анемия и гемохроматоз, как лечить, советы врачей
У мамы с II (Rh—) кровью возможна реакция на:
- белок III группы (В);
- белок IV группы (В);
- белок резуса (положительный).
У мамы с III (Rh—) кровью возможна реакция на:
- белок II группы (А);
- белок IV группы (А);
- белок резуса (положительный).
У женщин с IV(Rh—) кровью возможен конфликт, который вызывает иммунную реакцию только в случае, если у папы ребенка кровь резус-положительная (Rh+).
Резус-конфликт и его причины
«
«Резус-конфликт возможен при беременности, когда у матери резус отрицательный, а у ребенка положительный. Тогда организм женщины начинает сопротивляться клеткам крови плода. Эта ситуация возникает, когда ребенок зачат партнерами с разными резус-факторами, — поясняет Кирилл Ювченко. — Это опасно для здоровья женщины, поскольку возможна иммунная реакция организма матери против резус-положительных эритроцитов малыша. Иногда единственный выход — прерывание беременности. Но существует и мера профилактики — введение матери специального лекарства, чтобы предупредить иммунную реакцию».
Эксперт подчеркивает, если мать уже иммунизирована, то врачи определяют количество антител и проводят процедуру плазмафереза (забор некоторого объема крови) для уменьшения их количества.
Билирубин в крови: что означают повышенные показатели
В случае тяжелых последствий и вынужденного прерывания беременности важно сделать вакцину — антирезус иммуноглобулин в первые 72 часа.
Важность при переливании крови
Резус-принадлежность крайне важна при предоперационной подготовке пациента, когда есть вероятность, что понадобится гемотрансфузия (переливание донорской крови).
Если пациенту (реципиенту) с отрицательным резус-фактором перельют резус-положительную кровь, то его иммунная система отреагирует на этот антиген как на чужеродный и организм человека запустит выработку антител к нему. Как правило, в таких случаях образуется небольшое число антител, но при этом сохраняются так называемые клетки памяти (В-лимфоциты), которые помнят об антигене D. При повторном контакте с чужеродными эритроцитарными антигенами образуется множество антител, и донорские эритроциты массивно разрушаются.
Резус-конфликт при переливании крови вызывает посттрансфузионные осложнения:
- гемолитическая анемия;
- желтуха;
- острая почечная недостаточность;
- посттрансфузионный шок.
Профилактика
Современная медицина позволяет контролировать проблему несовместимости по резус-фактору. Женщины с отрицательным резусом во время беременности наблюдаются наиболее тщательно.
«
«Резус-фактор плода можно определить внутриутробно, обнаружив его ДНК в крови матери. Своевременная диагностика помогает избежать многих проблем при беременности и принять своевременные меры. Начать отслеживать состояние организма стоит еще до зачатия, — рассказал Кирилл Ювченко. — В лабораториях можно найти комплексы чекапов для будущих мам. Такого набора анализов будет достаточно, чтобы подготовиться к беременности».
До восьмого месяца беременности анализ на антитела врач проводит ежемесячно. С 32 недели исследование делают дважды в месяц, а с 36-й — каждую неделю. Это позволяет выявить начало резус-конфликта и после родов ввести специальный антирезусный иммуноглобулин, содержащий особые антитела для связывания антител матери.